题目内容
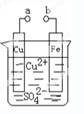
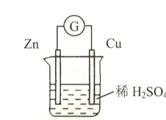
对于锌、铜和稀硫酸组成的原电池(如下图),下列有关说法正确的是

①Zn是负极 ②电子由Zn经外电路流向Cu
③Zn极的电极反应式是:Zn -2e-=Zn2+ ④Cu2+在溶液中由Cu棒向Zn棒迁移

①Zn是负极 ②电子由Zn经外电路流向Cu
③Zn极的电极反应式是:Zn -2e-=Zn2+ ④Cu2+在溶液中由Cu棒向Zn棒迁移
| A.①② | B.①②③ | C.②③④ | D.①②③④ |
B
试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,所以锌失去电子,做负极。铜是正极,溶液中的氢离子在正极得到电子,生成氢气,所以选项①②③正确,④不正确,答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型,属于基础性试题的考查。试题贴近教材,基础性强,有利于激发学生的学习兴趣和学习积极性。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。

练习册系列答案
相关题目