题目内容
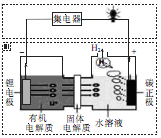
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
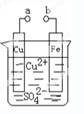

| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2+ + 2e-= Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b用导线连接时,铁片上发生的反应为:Fe — 3e-= Fe3+ |
D
试题分析:a和b不连接时,没有形成闭合回路,未构成原电池,但是铁比铜活泼,则铁片与硫酸铜溶液直接发生置换反应,即Fe+CuSO4=FeSO4+Cu,则铁片上会析出铜,故A正确;a和b用导线连接时,则铁片作负极,铜片作正极,溶液中铜离子和氢离子移向正极,铜离子的氧化性比氢离子强,则正极反应式为Cu2+ + 2e-= Cu,故B正确;无论a和b是否连接,铁片都会被氧化为亚铁离子,铜离子被还原为金属铜,溶液中铜离子浓度减小,亚铁离子浓度增大,故C正确;由于铁片过量,溶液中铁离子与过量的铁容易反应,生成亚铁离子,则形成原电池时,铁片上的反应式为Fe — 2e-= Fe2+,故D错。

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目