题目内容
一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
(1)当CO转化率为25%时,该反应是否达到平衡,若未达到,向哪个方向进行?
(2)达到平衡时,CO的转化率为多少?
(3)当CO的起始浓度仍为2mol·L-1,H2O(g)的起始浓度为6mol·L-1,求平衡时CO的转化率?
 CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:(1)当CO转化率为25%时,该反应是否达到平衡,若未达到,向哪个方向进行?
(2)达到平衡时,CO的转化率为多少?
(3)当CO的起始浓度仍为2mol·L-1,H2O(g)的起始浓度为6mol·L-1,求平衡时CO的转化率?
(1)反应未达到平衡, 平衡正方向移动 (2分)
(2)50% (3分) (3)75% (3分)
(2)50% (3分) (3)75% (3分)
试题分析:
CO(g) + H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)起始 2 2 0 0
转化 0.5 0.5 0.5 0.5
平衡量 1.5 1.5 0.5 0.5
Q=
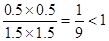 所以未达到平衡。
所以未达到平衡。(2)平衡时CO的物质的量浓度为1mol/L,所以转化率为50%。
(3)CO(g) + H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)起始 2 6 0 0
转化 x x x x
平衡量 2-x 6-x x x
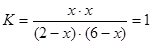 可知x=1.5 则平衡时CO的转化率为75%。
可知x=1.5 则平衡时CO的转化率为75%。
练习册系列答案
相关题目
 2R(g) ΔH>0。在图中Y轴是指
2R(g) ΔH>0。在图中Y轴是指
 2SO3(气),已知反应过程中某一时SO2、O2、SO3,的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(气),已知反应过程中某一时SO2、O2、SO3,的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是 2Z(g),当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是
2Z(g),当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是 2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g)  CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。
CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。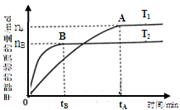
 2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是
2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是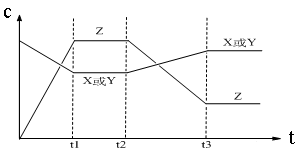
 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求:
2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求: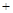 2H2(g)
2H2(g) CH3OH(g)
CH3OH(g) ”或“<”),要提高CO转化率,可采取的措施
”或“<”),要提高CO转化率,可采取的措施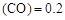 mol/L,则以CH3OH表示的反应速率v
mol/L,则以CH3OH表示的反应速率v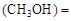 mol /(L·min),
mol /(L·min), 2CO(g) 平衡常数K1
2CO(g) 平衡常数K1