题目内容
卤素性质活泼,能形成卤化物、多卤化物等多种类型的化合物。
(1)卤化氢中,HF的沸点高于HCl,原因是____________________________
____________________________________________。
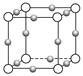
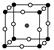
(2)如图为F-与Mg2+、K+形成的某种离子晶体的晶胞,其中“○”表示的离子是________(填离子符号)。
(3)多卤化物Rb[ICl2]分解时生成晶格能相对较大的铷(Rb)的卤化物,则该卤化物的化学式为_______________。
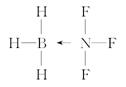
(4)BF3与NH3能发生反应生成X(H3BNF3),X的结构式为____________(用“→”表示出配位键):X中B原子的杂化方式为____________________________。
(5)有一类物质的性质与卤素类似,称为“拟卤素”[如(SCN)2、(CN)2等]。(CN)2的结构式为CNCN,该分子中σ键和π键数目之比为________。
(1)卤化氢中,HF的沸点高于HCl,原因是____________________________
____________________________________________。
(2)如图为F-与Mg2+、K+形成的某种离子晶体的晶胞,其中“○”表示的离子是________(填离子符号)。

(3)多卤化物Rb[ICl2]分解时生成晶格能相对较大的铷(Rb)的卤化物,则该卤化物的化学式为_______________。
(4)BF3与NH3能发生反应生成X(H3BNF3),X的结构式为____________(用“→”表示出配位键):X中B原子的杂化方式为____________________________。
(5)有一类物质的性质与卤素类似,称为“拟卤素”[如(SCN)2、(CN)2等]。(CN)2的结构式为CNCN,该分子中σ键和π键数目之比为________。
(1)HF分子间形成氢键 (2)F- (3)RbCl
(4) sp3杂化 (5)3∶4
sp3杂化 (5)3∶4
(4)
 sp3杂化 (5)3∶4
sp3杂化 (5)3∶4(1)HF、HCl均为分子晶体,其中HF能形成分子间氢键,使沸点升高。(2)由晶胞结构可知,黑球有1个,灰球有1个,白球有3个,由电荷守恒可知离子数关系为N(Mg2+)∶N(K+)∶N(F-)=1∶1∶3,得白球为F-。(3)分解时可形成RbI或RbCl两种卤化物,由于r(Cl-)<r(I-),所以后者晶格能大。(4)注意B为ⅢA族元素,最外层只有3个电子,有1个空轨道,N为VA族元素,有一对孤对电子,写出结构式。B原子形成4根键,即0+4=4,sp3杂化。(5)叁键中有1个σ键、2个π键,单键均为σ键。

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
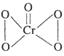 ,据此推断该氧化物
,据此推断该氧化物