题目内容
【题目】碱式碳酸铝镁[MgaAlb(OH)c(CO3)d]在一定条件下的转化如下图所示,下列说法正确的是
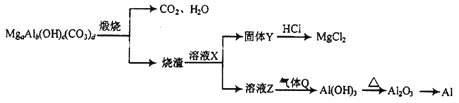
A. Q可能为NH3
B. X可能为NaOH
C. a、b、c、d符合关系式:2a+3b=c+2d
D. 工业上用CO还原Al2O3的方法制取金属Al
【答案】BC
【解析】结合流程进行分析,溶液Z可能为NaAlO2溶液,则气体Q可能为CO2,不可能为NH3,A错误;根据流程,烧渣主要为氧化镁和氧化铝,氧化铝具有两性能溶于强碱溶液,所以溶液X可能为NaOH溶液,B正确;化合物中Mg的化合价为+2、Al的化合价为+3、氢氧根的化合价为-1、碳酸根的化合价为-2,根据正负化合价代数和为0可得,2a+3b=c+2d,C正确;金属活动性顺序表中铝及排在铝前面的金属一般用电解法制取,所以工业上用电解Al2O3的方法制取金属Al,D错误;正确选项BC。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案【题目】异丙苯( ![]() )氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下: 氧化:
)氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下: 氧化: ![]() +O→
+O→ ![]() (异丙苯过氧氢)
(异丙苯过氧氢)
分解: ![]()
![]()
![]() (丙嗣)
(丙嗣)
已知:
物质 | 丙酮 | 苯酚 | 异丙苯 |
密度(g/mL) | 0.7898 | 1.0722 | 0.8640 |
沸点/°C | 56.5 | 182 | 153 |
完成下列填空:
(1)X物质是;Y物质是 .
(2)浓硫酸的作用是 , 其优点是用量少,可能的缺点是(写一条).
(3)Z物质最适宜选择(选填编号).a.NaOH b.Na2CO3 c.NaHCO3 d.CaCO3
(4)步骤⑥分馏,工业上在分馏塔中进行,如图  ,产品T是 , 请说明理由 . 废水中苯酚的含量,可根据苯酚与溴水的反应,用以下方法测定: ①把20.00mL废水、20mLKBrO3和KBr混合溶液[其中:c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L]置于锥形瓶中,再加入10mL6mol/L的盐酸,迅速盖好盖子,摇动锥形瓶.
,产品T是 , 请说明理由 . 废水中苯酚的含量,可根据苯酚与溴水的反应,用以下方法测定: ①把20.00mL废水、20mLKBrO3和KBr混合溶液[其中:c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L]置于锥形瓶中,再加入10mL6mol/L的盐酸,迅速盖好盖子,摇动锥形瓶.
②充分反应后,稍松开瓶塞,从瓶塞和瓶壁间缝隙迅速加入10%KI溶液10mL(过量),迅速加盖,充分摇匀.加入少许淀粉溶液.
③用0.0250mol/LNa2S2O3标准溶液滴定至终点.用去Na2S2O3溶液22.48mL.
(5)已知:BrO3﹣+5Br﹣+6H+→3Br2+3H2O;写出苯酚与浓溴水反应的化学方程式;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是 .
(6)已知:I2+2Na2S2O3→2NaI+Na2S4O6;滴定终点的现象是;该废水中苯酚的浓度是mol/L(保留4位小数).

