题目内容
【题目】下列说法正确的是( )
A.过量的100gNa2O2与CO2反应后,固体质量变成了105.6g,此反应转移电子为0.4mol
B.在Fe与含nmolHNO3的稀溶液反应中,被还原的HNO3不一定为![]() nmol
nmol
C.在Mg与Al做电极,其它溶液做电解质构成原电池中,Mg一定为负极
D.碱性氧化物一定为金属氧化物,酸性氧化物不一定是非金属氧化物
【答案】D
【解析】
A.由![]() 可知,过氧化钠中的四个氧原子,其中两个氧原子化合价从-1升高到0,另外两个氧原子化合价从-1降低到-2, 固体质量增加56g,转移2mol电子,则质量增加
可知,过氧化钠中的四个氧原子,其中两个氧原子化合价从-1升高到0,另外两个氧原子化合价从-1降低到-2, 固体质量增加56g,转移2mol电子,则质量增加![]() ,转移电子为
,转移电子为![]() ,故A错误;
,故A错误;
B.若生成硝酸铁,由![]() 可知,四个氮原子中,只有一个氮原子化合价降低,则被还原的的氮原子占总氮原子的四分之一,参加反应的硝酸为nmol,被还原的硝酸为
可知,四个氮原子中,只有一个氮原子化合价降低,则被还原的的氮原子占总氮原子的四分之一,参加反应的硝酸为nmol,被还原的硝酸为![]() ,故B错误;
,故B错误;
C.若电解质为NaOH,则Al失去电子,则Al为负极,Mg为正极,故C错误;
D.碱性氧化物一定含金属元素,则碱性氧化物一定为金属氧化物,而酸性氧化物中不一定含非金属元素,如![]() 、
、![]() 均为酸性氧化物,故D正确;
均为酸性氧化物,故D正确;
答案选D。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】乙二酸俗称草酸![]() 结构简式为
结构简式为![]() ,可简写为
,可简写为![]() ,它是一种重要的化工原料.
,它是一种重要的化工原料.![]() 常温下
常温下![]() 的
的![]() 、
、![]() 、
、![]() 溶液的pH如表所示.
溶液的pH如表所示.![]()
|
|
| |
pH |
|
|
|
填空:
![]() 写出
写出![]() 的电离方程式______.
的电离方程式______.
![]() 溶液显酸性的原因是______;向
溶液显酸性的原因是______;向![]() 的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______.
的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______.
a.![]()
![]()
![]()
![]()
![]() 与酸性高锰酸钾溶液反应,现象是有气泡
与酸性高锰酸钾溶液反应,现象是有气泡![]() 产生,紫色消失。写出反应的离子方程式______;又知该反应开始时速率较慢,随后大大加快,可能的原因是______.
产生,紫色消失。写出反应的离子方程式______;又知该反应开始时速率较慢,随后大大加快,可能的原因是______.
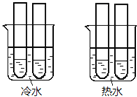
![]() 某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL
某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL![]()
![]()
![]() 溶液和4mL
溶液和4mL![]() 酸性
酸性![]() 溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究______,但该实验始终没有看到溶液褪色,推测原因______.
溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究______,但该实验始终没有看到溶液褪色,推测原因______.
![]() 已知草酸
已知草酸![]() 受热分解的化学方程式为:
受热分解的化学方程式为:![]() ,写出
,写出![]() 在密闭容器中高温分解的化学方程式______.
在密闭容器中高温分解的化学方程式______.