题目内容
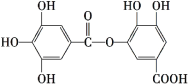
【题目】国务院强调,“南水北调”工程必须坚持节水、治污和生态环境保护与工程建设相协调,以水资源合理配置为主线,把节水、治污和生态环境保护与调水作为一个完整的系统来分析的原则。在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患。经检测,某工厂废液中含有大量的![]() 、
、![]() 、
、![]() 、
、![]() 。试分析并回答下列问题:
。试分析并回答下列问题:
(1)该废液中可能大量存在的阴离子是________(填序号)。
A ![]() B
B ![]() C
C ![]() D
D ![]()
(2)为了回收废液中的金属银,某同学设计了如图所示的实验方案。若按照该方案获得金属银108g,在保证不污染环境且![]() 循环利用的情况下,可得出理论上应提供标准状况下的
循环利用的情况下,可得出理论上应提供标准状况下的![]() ________L。
________L。
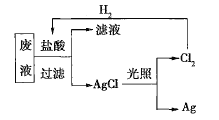
(3)为了实现(2)中氯气的循环利用,有人设想以氢气和氯气为原料利用原电池原理直接制盐酸,假设这种想法可行,下列说法肯定错误的是________(填序号)。
A 两极材料都用石墨,用稀盐酸作电解质溶液
B 通入氢气的电极为原电池的正极
C 电解质溶液中的阳离子向通入氯气的电极移动
D 通入氯气的电极的电极反应式为![]()
【答案】B 11.2 B
【解析】
(1)NO3-与四种阳离子均不反应,而其他三种阴离子均能与四种阳离子中的一种或多种结合生成沉淀,所以选B;
(2)当回收108g金属银即1molAg时,有0.5molCl2生成;将生成的氯气与氢气反应使之转化为方案中所需要的盐酸,需要0.5molH2,消耗标准状况下的氢气![]() ;
;
(3)电池的总反应为:H2+Cl2=2HCl,根据原电池原理可知:
A.两极材料可以都用石墨,一极通入氢气,一极通入氯气,可以用稀盐酸做电解质溶液,故A正确;
B.反应H2+Cl2=2HCl中,氢气失电子,所以通入氢气的电极为原电池的负极,故B错误;
C.在原电池中,电解质溶液中的阳离子向正极移动,通氯气的电极为正极,故C正确;
D.通氯气的电极为正极,发生得电子得还原反应,电极反应式为:Cl2+2e-→2Cl-,故D正确;
综上所述选B。