题目内容
【题目】已知有关反应的能量变化如图,试回答下列问题。
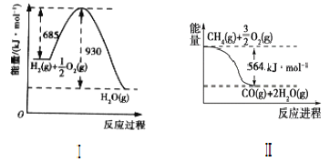
(1)根据图像,写出Ⅰ的热化学方程式:____。
(2)写出CH4(g)与H2O(g)反应制取CO(g)和H2(g)的热化学方程式:____。
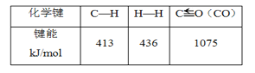
(3)在(2)的反应中,相关的化学键键能数据如下表所示。判断H2O(g)中O—H的键能为___。
(4)试比较下列两组△H的大小(填“>”、“<”或“=”)
①C(s)+CO2(g)=2CO(g)△H1,C(s)+![]() O2(g)=CO(g)△H2则△H1___△H2。
O2(g)=CO(g)△H2则△H1___△H2。
②CH4(g)+H2O(g)=CO(g)+3H2(g)△H3,CH4(g)+H2O(l)=CO(g)+3H2(g)△H4,则△H3___△H4
③2H2(g)+O2(g)=2H2O(1)△H4,2H2(g)+O2(g)=2H2O(g)△H5,则△H4___△H5。
【答案】H2(g)+![]() O2(g)=H2O(g) ΔH=-245kJ/mol CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+171kJ·mol-1 451kJ/mol > < <
O2(g)=H2O(g) ΔH=-245kJ/mol CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+171kJ·mol-1 451kJ/mol > < <
【解析】
(1)根据图像,反应Ⅰ是1molH2与![]() molO2的反应,反应放出的热量为930 kJ/mol -685 kJ/mol =245kJ/mol,故热化学方程式为H2(g)+
molO2的反应,反应放出的热量为930 kJ/mol -685 kJ/mol =245kJ/mol,故热化学方程式为H2(g)+![]() O2(g)=H2O(g) ΔH=-245kJ/mol;
O2(g)=H2O(g) ΔH=-245kJ/mol;
(2)设H2(g)+![]() O2(g)=H2O(g) ΔH=-245kJ/mol为式①,
O2(g)=H2O(g) ΔH=-245kJ/mol为式①,
根据图II得,CH4(g)+![]() O2(g)=CO(g)+2H2O(g) ΔH=-564kJ/mol,设此反应为式②,
O2(g)=CO(g)+2H2O(g) ΔH=-564kJ/mol,设此反应为式②,
反应CH4(g)+H2O(g)=CO(g)+3H2(g)可由②-3×①得到,该反应的ΔH=-564kJ/mol-3×(-245kJ/mol)= +171kJ/mol,故热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+171kJ·mol-1;
(3)设O—H的键能为x,413 kJ/mol×4+2x-1075 kJ/mol -436 kJ/mol×3=171 kJ/mol,解得x=451kJ/mol;
(4)①C与CO2的反应为吸热反应,故△H1>0,C与O2的反应为放热反应,故△H2<0,所以△H1>△H2;
②H2O(g)生成 H2O(l)的过程为放热,所以第一个反应放出的热量更多,故△H3<△H4;
③H2O(l) 生成H2O(g) 的过程为吸热,所以第二个反应放出的热量少,故△H4<△H5;