题目内容
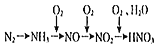
【题目】海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mgL-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示):____________,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。

① 开始时阳极的电极反应式为________________。
② 电解一段时间,____极(填“阴”或“阳”)会产生水垢,其成份为_____(填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:

该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示_____(填粒子符号),充电时该电极反应式为_______。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为_________(空气中氧气的体积分数按20%计)。
【答案】HCO3-+H2O![]() H2CO3+OH- 4×10-3 2Cl--2e-=Cl2↑ 阴 CaCO3和Mg(OH)2 b Li+ LiFePO4-e-=FePO4+Li+ 1:5
H2CO3+OH- 4×10-3 2Cl--2e-=Cl2↑ 阴 CaCO3和Mg(OH)2 b Li+ LiFePO4-e-=FePO4+Li+ 1:5
【解析】
(1)海水中含有碳酸氢根离子,水解显碱性,离子方程式为HCO3-+H2O![]() H2CO3+OH-;根据表中数据可知该海水中Ca2+的物质的量浓度为
H2CO3+OH-;根据表中数据可知该海水中Ca2+的物质的量浓度为![]() =4×10-3mol/L;
=4×10-3mol/L;
(2)①电解池中阳极失去电子,发生氧化反应,因此开始时是海水中的氯离子放电,则开始时阳极的电极反应式为2Cl--2e-=Cl2↑;
②由于阴极是氢离子放电生成氢气,从而在阴极产生氢氧根,氢氧根与镁离子结合生成CaCO3和Mg(OH)2,产生的氢氧根还能与碳酸氢根反应生成碳酸根,因此还有碳酸钙沉淀产生,则电解一段时间,阴极会产生水垢,其成份为CaCO3和Mg(OH)2;
③在外加电流的作用下海水中的阴阳离子分别通过阴离子交换膜和阳离子交换膜移动,从而使1个间隔室的海水被淡化,而相邻间隔室的海水被浓缩,则根据装置图可知a和c是被浓缩的海水,则淡水的出口为b口;
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如右图所示:该电池电解质为能传导 Li+的固体材料。这说明锂是该电池的负极,失去电子,阳离子Li+向正极移动。则根据示意图可知左图中的小黑点表示Li+。充电是放电的逆反应,即该电极是阳极,阳极失去电子,则充电时该电极的反应式为LiFePO4-e-=FePO4+Li+;
(4)假设反应中得到1mol高锰酸钾,则由锰酸钾转化为高锰酸钾时锰元素的化合价从+6价升高到+7价,失去1个电子,则需要氯气0.5mol,得到1mol锰酸钾,其中锰元素的化合价从+4价升高到+6价,失去2个电子。氧气在反应中得到4个电子,则根据电子得失守恒可知需要氧气是0.5mol,因此氯气与氧气的体积之比是1:1,又因为氧气在空气中的体积份数是0.2,因此氯气与空气的体积比为1:5。

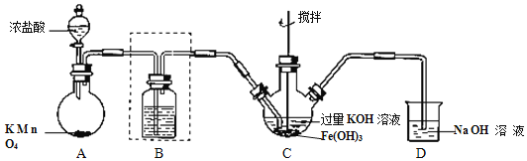
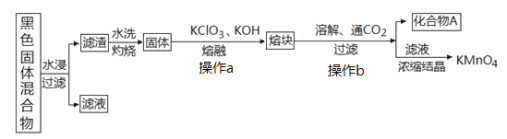
【题目】下图表示从废旧普通锌锰电池内容物中回收制备KMnO4等物质的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
(1)KMnO4稀溶液是一种常用消毒剂,其消毒机理与下列物质相似的是______________(填序号)
A.双氧水B.75%酒精C.84消毒液(NaClO溶液)D.苯酚
(2)①黑色固体混合物水浸时为提高浸出速率,常采用的措施为_____________________(答出一条即可)。
②滤渣水洗灼烧后固体是一种黑色的化合物,操作a中得到熔块的主要成分是K2MnO4和KCl,该过程中发生反应的化学方程式为:_____________________________。
③图中产物A是一种难溶于水的黑色固体,常在有些反应中作催化剂,其化学式为:_________________。
(3)某实验小组用提纯后的KMnO4配置成0.1000mol/L溶液来测定某试样中过氧化氢的含量
①查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:_____。
②配制250mL0.100mol/L标准KMnO4溶液,需要使用的玻璃仪器有烧杯、胶头滴管、量筒和、___________;
③滴定反应原理为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,该反应中H2O2体现___________(填“氧化性”、“还原性”、“酸性”);
④用0.100mol/L标准KMnO4溶液滴定含H2O2试样的溶液时,KMnO4溶液(酸化)放在_____滴定管中,并判断滴定至终点的现象是_____。
⑤用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的高锰酸钾体积如表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为___________mol/L。
⑥下列操作会引起测定结果偏高的是___________。
A.滴定管在盛装高锰酸钾前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.锥形瓶未用待测液润洗
【题目】25℃时,电离平衡常数如下表,下列说法错误的是
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
A.离子结合质子的能力由大到小的顺序是:CO32- > ClO- > HCO3- > CH3COO-
B.2ClO-+CO2+H2O=CO32-+2HClO反应不能发生
C.用蒸馏水稀释0.10mol·L-1的醋酸,c(CH3COO-)/c(CH3COOH)的数值逐渐增大
D.等体积、等pH的CH3COOH与HClO两溶液与NaOH恰好完全反应,CH3COOH消耗氢氧化钠物质的量更多