题目内容
4.下列性质的递变规律不正确的是( )| A. | F、O、N非金属性依次减弱,HF、H2O、NH3沸点依次降低 | |
| B. | Li、Na、K、Rb、Cs的失电子能力逐渐增强 | |
| C. | Al3+、Mg2+、Na+的离子半径依次增大 | |
| D. | HF、HCl、HBr、HI稳定性依次减弱,还原性依次增强 |
分析 A、HF、H2O、NH3中均存在氢键,据此解答即可;
B、元素的金属性越强,失电子能力越强;
C、核外电子排布相同的离子,原子序数越大,半径越小;
D、元素的非金属性越强,其对应氢化物越稳定,还原性越弱.
解答 解:A、HF、H2O、NH3中均存在氢键,每个水分子可以形成2个氢键,故水的沸点最高,故A错误;
B、元素的金属性越强,其越容易失去电子,故B正确;
C、核外电子排布相同的离子,原子序数越大,半径越小,故Al3+、Mg2+、Na+的离子半径依次增大正确,故C正确;
D、元素的非金属性越强,其对应氢化物越稳定,还原性越弱,由于分金属性F>Cl>Br>I,故HF、HCl、HBr、HI稳定性依次减弱,还原性依次增强正确,故D正确,故选A.
点评 本题考查元素周期律知识,题目难度不大,本题注意元素的非金属性、金属性与元素对应单质、化合物的关系.

练习册系列答案
相关题目
14.下列对于核素的说法中正确的是( )
| A. | 核素是指质量数相同的微粒 | |
| B. | 核素是指 质子数相同、中子数不同的微粒 | |
| C. | 核素是指具有一定数目的质子和一定数目的中子的一种原子 | |
| D. | 核素是指质子数相同、核外电子数不同的微粒 |
15.在恒温下的密闭容器中,有可逆反应N2+3H2?2NH3(该反应放热),不能说明已达到平衡状态的是( )
| A. | 正反应生成的NH3速率和逆反应生成N2的速率相等 | |
| B. | 反应器中压强不随时间变化而变化 | |
| C. | 1molN≡N键断裂的同时,有6molN-H键断裂 | |
| D. | 混合气体平均分子量保持不变 |
12.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:

已知:①浸出液含有阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成CoCl2.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出加适量NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,依次是蒸发浓缩,冷却结晶和过滤.
(5)萃取剂对金属离子的萃取率与pH的关系如图1.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B(填选项序号).
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水(答一条即可).
(7)已知某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌
入电池负极材料碳-6(C6)中(如图2所示).若该电池的总反应为LiCoO2+C6$?_{放点}^{充电}$CoO2+LiC6,则电池放
电时的正极反应式为:CoO2+Li++e-=LiCoO2.


已知:①浸出液含有阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出加适量NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,依次是蒸发浓缩,冷却结晶和过滤.
(5)萃取剂对金属离子的萃取率与pH的关系如图1.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B(填选项序号).
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水(答一条即可).
(7)已知某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌
入电池负极材料碳-6(C6)中(如图2所示).若该电池的总反应为LiCoO2+C6$?_{放点}^{充电}$CoO2+LiC6,则电池放
电时的正极反应式为:CoO2+Li++e-=LiCoO2.

9.如图类似于教材P14关于验证“氯气的漂白性实验”的装置图.但在实验时,某同学将A、B两装置的先后位置交换了,则该同学可能看到的实验现象是( )

| A. | 只有干燥的布条褪色 | B. | 只有湿润的布条褪色 | ||
| C. | 两块布条均褪色 | D. | 两块布条均不褪色 |
16.当把晶体N2O4放入恒容的密闭容器内,待全部气化并建立N2O4?2NO2平衡后,保持温度不变,再加入N2O4晶体并全部气化,待反应达到新的平衡,新平衡与旧平衡比较,其值减小的是( )
| A. | c(NO2) | B. | c(N2O4) | C. | $\frac{c(N{O}_{2})}{c({N}_{2}{O}_{4})}$ | D. | $\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$ |
 单体为CH2═CH-Cl.
单体为CH2═CH-Cl. 单体为CH2═CH-CH═CH2,
单体为CH2═CH-CH═CH2, 单体为
单体为 ,
, 单体为HO-CH2CH2-OH和HOOC-COOH.
单体为HO-CH2CH2-OH和HOOC-COOH. 硫代硫酸钠(Na2S2O3•5H2O)是一种脱氯剂,它易溶于水,难溶于乙醇,40~45℃熔化,48℃分解,由硫化钠和亚硫酸钠制备,涉及的反应原理为:
硫代硫酸钠(Na2S2O3•5H2O)是一种脱氯剂,它易溶于水,难溶于乙醇,40~45℃熔化,48℃分解,由硫化钠和亚硫酸钠制备,涉及的反应原理为: .
.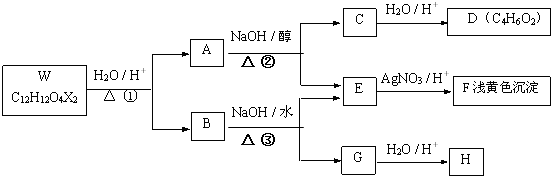

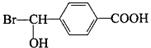
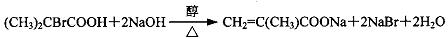
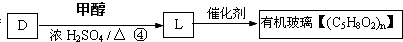 ,反应④的化学方程式是
,反应④的化学方程式是
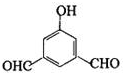 、
、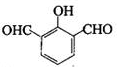 、
、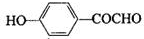 .
.