题目内容
16.当把晶体N2O4放入恒容的密闭容器内,待全部气化并建立N2O4?2NO2平衡后,保持温度不变,再加入N2O4晶体并全部气化,待反应达到新的平衡,新平衡与旧平衡比较,其值减小的是( )| A. | c(NO2) | B. | c(N2O4) | C. | $\frac{c(N{O}_{2})}{c({N}_{2}{O}_{4})}$ | D. | $\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$ |
分析 保持温度不变,再加入N2O4晶体并全部气化,反应物浓度增大,平衡正向移动,但反应物参加反应增加的量小于加入的量,所以反应物转化率降低,温度不变,化学平衡常数不变,据此分析解答.
解答 解:保持温度不变,再加入N2O4晶体并全部气化,反应物浓度增大,平衡正向移动,但反应物参加反应增加的量小于加入的量,所以反应物转化率降低,温度不变,化学平衡常数不变,
A.平衡正向移动,n(NO2)增大,容器体积不变,导致c(NO2)增大,故A错误;
B.虽然加入四氧化二氮后平衡正向移动,但反应物参加反应增加的量小于加入的量,容器体积不变,所以n(N2O4)增大,导致c(N2O4)增大,故B错误;
C.温度不变,则化学平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$不变,但c(NO2)增大,导致$\frac{c(N{O}_{2})}{c({N}_{2}{O}_{4})}$减小,故C正确;
D.温度不变,则化学平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$不变,则$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$不变,故D错误;
故选C.
点评 本题考查化学平衡影响因素,为高频考点,明确“加入N2O4后虽然平衡正向移动但N2O4的转化率降低”是解本题关键,注意C选项的变式,为学习难点,注意化学平衡常数只与温度有关,与物质浓度无关,题目难度中等.

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
6.某有机物的分子式为C3H6O,通过核磁共振氢谱分析有3个峰,峰面积比例为1:2:3,则该物质可能是( )
| A. | CH3COCH3 | B. | CH3CH2CHO | C. | CH2=CH-CH2OH | D. | CH2=CH-O-CH3 |
7.过氧化钠可作为氧气的来源.常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了14g,反应中有关物质物理量正确的是(NA表示阿伏加德罗常数) ( )
| 二氧化碳 | 碳酸钠 | 转移的电子 | |
| A | 0.5mol | NA | |
| B | 53g | 0.5mol | |
| C | 53g | NA | |
| D | 11.2L | 0.5mol |
| A. | A | B. | B | C. | C | D. | D |
4.下列性质的递变规律不正确的是( )
| A. | F、O、N非金属性依次减弱,HF、H2O、NH3沸点依次降低 | |
| B. | Li、Na、K、Rb、Cs的失电子能力逐渐增强 | |
| C. | Al3+、Mg2+、Na+的离子半径依次增大 | |
| D. | HF、HCl、HBr、HI稳定性依次减弱,还原性依次增强 |
11.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| B. | PH=1的亚硫酸溶液中含有的H+数目为0.1NA | |
| C. | 2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1Na | |
| D. | 0.1 mol的Na2O2中含阴离子数是0.2 NA |
12.S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:
①CS2+3Cl2 $\stackrel{111-140℃}{→}$ CCl4+S2Cl2;②2S+Cl2 $\stackrel{95-100℃}{→}$ S2Cl2.
已知S2Cl2中硫元素显+1价,电子式: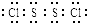 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:
实验室利用下列装置制备S2Cl2(部分夹持仪器已略去):

回答下列问题:
(1)装置B、C中玻璃容器的名称:广口瓶;反应原理(填写数字序号):①.
(2)实验中盐酸试剂通常采用36.5%的浓溶液,不用稀盐酸的理由是稀盐酸还原性弱,反应困难.
(3)D中冷凝管起到导气和冷凝双重作用,其冷却水流动方向与热气流流动方向相同(见图).这种冷却方式可应用于下列高中化学中BD实验.
A.石油分馏 B.制取溴苯 C.制取乙酸乙酯 D.制备阿司匹林
(4)B装置中盛放的是饱和食盐水,反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏,D中采用热水浴加热的原因是使CS2平稳汽化,避免产物S2Cl2汽化.
(5)A部分仪器装配时,放好铁架台后,应先固定酒精灯(填仪器名称),整套装置装配完毕后,应先进行气密性检查再添加试剂.实验完毕,A中不再产生氯气时,可拆除装置.拆除时,最先的操作应当是将E中长导管移开液面.
(6)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因可用化学方程式表示为2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑.实验完毕,当把剩余浓盐酸倒入E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是:ClO-+2H++Cl-=Cl2↑+H2O(用离子方程式表示).
①CS2+3Cl2 $\stackrel{111-140℃}{→}$ CCl4+S2Cl2;②2S+Cl2 $\stackrel{95-100℃}{→}$ S2Cl2.
已知S2Cl2中硫元素显+1价,电子式:
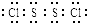 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |

回答下列问题:
(1)装置B、C中玻璃容器的名称:广口瓶;反应原理(填写数字序号):①.
(2)实验中盐酸试剂通常采用36.5%的浓溶液,不用稀盐酸的理由是稀盐酸还原性弱,反应困难.
(3)D中冷凝管起到导气和冷凝双重作用,其冷却水流动方向与热气流流动方向相同(见图).这种冷却方式可应用于下列高中化学中BD实验.
A.石油分馏 B.制取溴苯 C.制取乙酸乙酯 D.制备阿司匹林
(4)B装置中盛放的是饱和食盐水,反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏,D中采用热水浴加热的原因是使CS2平稳汽化,避免产物S2Cl2汽化.
(5)A部分仪器装配时,放好铁架台后,应先固定酒精灯(填仪器名称),整套装置装配完毕后,应先进行气密性检查再添加试剂.实验完毕,A中不再产生氯气时,可拆除装置.拆除时,最先的操作应当是将E中长导管移开液面.
(6)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因可用化学方程式表示为2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑.实验完毕,当把剩余浓盐酸倒入E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是:ClO-+2H++Cl-=Cl2↑+H2O(用离子方程式表示).
10.雾霾严重影响人们的生活与健康.某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-.某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如图实验,已知:3NO3-+8Al+5OH-+2H2O$\stackrel{△}{→}$3NH3↑+8AlO2-,根据以上的实验操作与现象,该同学得出的结论正确的是( )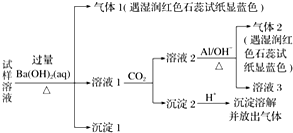

| A. | 试样中肯定存在NH4+、Mg2+、SO42-和NO3- | |
| B. | 试样中一定不含Al3+ | |
| C. | 试样与Na2CO3溶液一定不能大量共存 | |
| D. | 该雾霾中可能存在NaNO3、NH4Cl和MgSO4 |

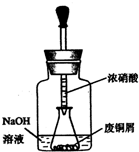 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下: