题目内容
【题目】已知 H2CO3 ![]() HCO3-+H+ K1=4.3×10-7 HCO3
HCO3-+H+ K1=4.3×10-7 HCO3 ![]() CO32-+H+ K2=5.6×10-11
CO32-+H+ K2=5.6×10-11
HClO ![]() ClO-+H+ K=3.0×10-8
ClO-+H+ K=3.0×10-8
H2SO3 ![]() HSO3-+H+ K1=1.54×10-2 HSO3-
HSO3-+H+ K1=1.54×10-2 HSO3- ![]() SO32-+H+ K2=1.02×10-11
SO32-+H+ K2=1.02×10-11
根据电离平衡常数分析,下列各式中正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO=CO32-+2HClO
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO═CaSO3↓+2HClO
C.空气中CO2和水蒸气与Ca(ClO)2溶液反应:Ca2++2ClO+CO2+H2O═CaCO3↓+2HClO
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-═CO2↑+H2O
【答案】C
【解析】
电离平衡常数越大,电离程度越大,酸性就越强,依据电离常数大小判断酸性强弱,H2SO3>H2CO3> HClO> HCO3-> HSO3-,
A、HClO的酸性比碳酸弱,比碳酸氢根离子强,所以少量CO2通入次氯酸钠溶液中:反应为CO2+H2O+ClO=HCO3-+HClO,故A错误;
B. 次氯酸具有强氧化性,能把+4价S氧化成+6价,转变成CaSO4,故B错误;
C、虽然酸性H2CO3>HClO>HCO3,但碳酸钙难溶,反应可以发生,故C正确;
D. 亚硫酸根属于弱酸酸式根,不能拆写,由电离常数可知酸性HSO3比碳酸弱,不能生成二氧化碳气体,故D错误;
故选C。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】化学反应速率、限度及能量与生产、生活密切相关。
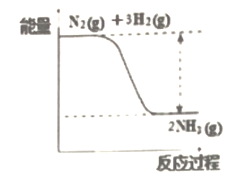
(1)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2+3H2![]() 2NH3。合成氨反应中的能量变化如图所示,该反应中,反应物化学键断裂吸收的总能量___(填“大于”或“小于”)生成物化学键形成放出的总能量。
2NH3。合成氨反应中的能量变化如图所示,该反应中,反应物化学键断裂吸收的总能量___(填“大于”或“小于”)生成物化学键形成放出的总能量。
(2)小王同学为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 50 | 190 | 414 | 526 | 570 |
①求2~4分钟时间段以盐酸的浓度变化来表示的该反应速率___。(设溶液体积不变)
②小蒋同学认为在盐酸溶液中滴入少量的CuSO4溶液可以加快反应的速率,请从电化学的角度给子构成的原电池中负极反应式为___;溶液中H+移向___极(填“正“或“负")。
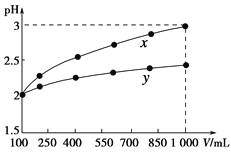
(3)某温度下在4L恒容密闭容器中,3种气态物质X、Y、Z的物质的量随时间变化曲线如图。
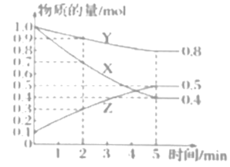
①写出该反应的化学方程式___。
②在5min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是___。
A.X、Y、Z的浓度相等
B.容器内气体压强保持不变
C.X、Y的反应速率比为3:1
D.生成1molY的同时生成2molZ
③该反应达平衡时,X的转化率为___。