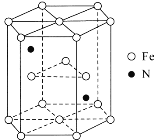
题目内容
【题目】下列各式中属于正确的水解方程式的是( )
A.Fe3+ + 3H2O![]() Fe(OH)3↓ + 3H+B.S2-+2H2O
Fe(OH)3↓ + 3H+B.S2-+2H2O![]() H2S + 2OH-
H2S + 2OH-
C.NH4+ + H2O![]() NH3·H2O + H+D.CH3COOH + H2O
NH3·H2O + H+D.CH3COOH + H2O![]() CH3COO- + H3O+
CH3COO- + H3O+
【答案】C
【解析】
A、水解是微弱的,生成少量Fe(OH)3,不标沉淀符号,正确的水解方程式为Fe3+ + 3H2O![]() Fe(OH)3 + 3H+,选项A错误;
Fe(OH)3 + 3H+,选项A错误;
B、S2-分步水解,第一步水解的方程式为S2-+H2O![]() HS- + OH-,选项B错误;
HS- + OH-,选项B错误;
C、NH4+水解生成NH3·H2O和H+,选项C正确;
D、CH3COOH + H2O![]() CH3COO- + H3O+是醋酸的电离方程式,不是水解方程式,选项D错误;
CH3COO- + H3O+是醋酸的电离方程式,不是水解方程式,选项D错误;
答案选C。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】实验室常用亚硫酸钠固体和70%的浓硫酸制备SO2气体,反应方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,请设计一套实验装置,收集一试管干燥的SO2气体。
(1)在下面方框中,A表示由分液漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必画出,尾气处理部分必须画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C…;其它可选用的仪器(数量不限)简易表示如下:___

(2)根据方框中的装置图甲,在答题卡上填写下表(可不填满)___
仪器标号 | 仪器中所加物质 | 作用 |
A | 亚硫酸钠、浓硫酸 | 产生SO2 |
(3)某实验小组用如图乙装置测定收集到的气体中SO2的含量,反应管中装有酸性高猛酸钾溶液。
①SO2和酸性高猛酸钾溶液发生反应的离子方程式为:___。
②反应管内溶液紫红色消失后,若没有及时停止通气,则测得的SO2含量___(选填:“偏高”、“偏低”或“无影响”)
③若酸性高猛酸钾溶液体积为V1mL,浓度为cmol/L,量气管内增加的水的体积为V2mL(已折算成标准状况下的体积)。用c、V1、V2表示SO2的体积百分含量为___。