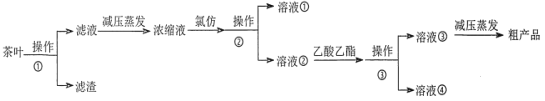
题目内容
【题目】某条件下,某气态烃的混合气体 0.1mol,完全燃烧后生成 4.05 g 水和 0.15 mol CO2,该 烃的组成为
①CH4、C2H4 ②C2H6、C2H4 ③CH4、C3H6 ④C2H6、C3H6 ⑤CH4、C2H6 ⑥CH4、C3H8
A.①②B.③④C.③⑤⑥D.③
【答案】D
【解析】
某气态烃的混合气体 0.1mol完全燃烧,n(H2O)=![]() =0.225mol, n(CO2)=0.15mol,则n(H)=0.45mol,n(C)= 0.15mol,混合气的平均组成为C1.5H4.5,说明两分子的平均碳原子数为1.5,一定含有CH4,则另一气态分子中含碳原子数大于1.5(气态烃,其分子中碳原子数不大于4),氢原子数大于4.5,由此可得出可能答案为③CH4、C3H6;⑤CH4、C2H6;⑥CH4、C3H8。
=0.225mol, n(CO2)=0.15mol,则n(H)=0.45mol,n(C)= 0.15mol,混合气的平均组成为C1.5H4.5,说明两分子的平均碳原子数为1.5,一定含有CH4,则另一气态分子中含碳原子数大于1.5(气态烃,其分子中碳原子数不大于4),氢原子数大于4.5,由此可得出可能答案为③CH4、C3H6;⑤CH4、C2H6;⑥CH4、C3H8。
然后利用平均组成验证这三组物质,当用C、H所计算出的二者的物质的量之比相等时,符合题意,从而得出只有③CH4、C3H6利用C、H计算出的二者的物质的量之比都为3:1,即只有③符合题意,故选D。

练习册系列答案
相关题目