题目内容
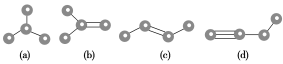
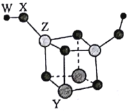
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,四种元素可以组成一种分子簇,其分子结构如图所示(球的大小表示原子半径的相对大小),W、X位于不同周期,X原子的最外层电子数是次外层电子数的3倍,Z的族序数等于其周期数,下列说法中正确的是( )。
A.W和X可以组成原子个数比为2:1和1:1的离子化合物
B.工业上可采用电解Z的熔融氯化物的方法制得单质Z
C.Z的最高价氧化物对应水化物的碱性比Y的强
D.X、Y、Z三种元素的离子半径由小到大顺序为Z<Y<X
【答案】D
【解析】
X原子的最外层电子数是次外层电子数的3倍,则X为O元素;Z的族序数等于其周期数,其原子序数大于O,则Z为Al元素;W、X位于不同周期,图中W的原子半径小于X的,故W为H元素;四种元素组成分子簇的化学式为H2Al2O5Y2,结合化合价为0可知,Y的化合价为+2,其原子半径大于Al,则Y为Mg元素。则W、X、Y、Z分别为H、O、Mg、Al。
A.W为H、X为O,组成原子个数比为2:1和1:1的化合物分别为H2O、H2O2,都为共价化合物,A错误;
B.Z为Al,AlCl3为共价化合物,熔融状态下不导电,工业上通过电解熔融氧化铝得到铝,B错误;
C.Y为Mg、Z为Al,同周期从左到右,金属性减弱,即金属性:Mg>Al,则最高价氧化物对应水化物的碱性:Y>Z,C错误;
D. X、Y、Z三种元素的离子分别为O2-、Mg2+、Al3+,离子核外电子层数越多,其离子半径越大,电子层数相同的离子,离子半径随原子序数增大而减小,故X、Y、Z三种元素的离子半径由小到大顺序为Z<Y<X,D正确;
答案选D。

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化