题目内容
【题目】已知![]() 可用
可用![]() 来检验呈蓝色
来检验呈蓝色![]() 将图I装置中的铁棒末段分别联上一块锌片和铜片,并静置于含有
将图I装置中的铁棒末段分别联上一块锌片和铜片,并静置于含有![]() 及酚酞的混合凝胶上.一段时间后发现凝胶的某些区域(如图)II示发生了变化.则下列说法正确的是
及酚酞的混合凝胶上.一段时间后发现凝胶的某些区域(如图)II示发生了变化.则下列说法正确的是
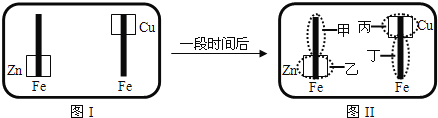
A.甲区不变色B.乙区呈现蓝色
C.丙区产生![]() 离子D.丁区产生
离子D.丁区产生![]() 离子
离子
【答案】D
【解析】
铁棒末段分别联上一块锌片和铜片,并静置于含有K3Fe(CN)6及酚酞的混合凝胶上,则形成原电池装置,活泼金属为负极,甲区发生电极反应:O2+2H2O+4e-=4OH-,乙区发生电极反应:2Zn-4e-=2Zn2+,丙区发生电极反应:O2+2H2O+4e-=4OH-,丁区发生电极反应:2Fe-4e-=2Fe2+,根据电极反应式来判断各个电极的变化情况。
A.甲区发生电极反应:O2+2H2O+4e-=4OH-,生成的氢氧根离子能使酚酞变红色,所以甲极区变红色,故A错误;
B.乙区发生电极反应:2Zn-4e-=2Zn2+,所以乙极区不变色,故B错误;
C.丙区发生电极反应:O2+2H2O+4e-=4OH-,不会产生铜离子,故C错误;
D.丁区发生电极反应:2Fe-4e-=2Fe2+,故D正确;
故选D。

【题目】化工原料水合肼(N2H4·H2O)是一种强还原性的碱性液体。
Ⅰ.实验室用下图装置制备水合肼(N2H4·H2O)。
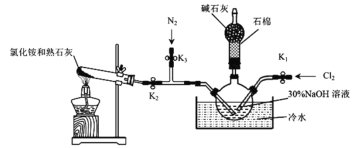
实验步骤:关闭K2、K3,打开K1,制备 NaClO;关闭K1、K2,打开K3,通入N2一段时间;关闭K3,打开K2,点燃酒精灯。回答下列问题:
(1)盛放碱石灰的仪器的名称为___________________。
(2)配制30%NaOH溶液时,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和_________。
(3)步骤2中通入N2一段时间的原因是____________________________________。
(4)水槽中放入冷水的目的是_____________________________________________。
(5)NH3与 NaClO反应生成N2H4·H2O的化学方程式为_______________________。
Ⅱ.已知:N2H4·H2O+2I2=N2↑+4HI+H2O,测定水合肼粗产品的纯度步骤如下:
a.称取N2H4·H2O粗产品(其它杂质不与I2反应)2.000g。
b.加水配成250.00mL溶液。
c.移出25.00mL置于锥形瓶中,滴加几滴淀粉溶液。
d.用0.3000mol·L-1的碘标准溶液进行滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗碘标准溶体积/mL | 20.24 | 20.02 | 19.98 |
f.数据处理。
(6)碘标准溶液盛放在____________(填“酸式”或“碱式”)滴定管中。在滴定管中装入碘标准溶的前一步,应进行的操作为_________,达到终点的现象是__________。
(7)消耗的碘标准溶平均体积为______mL,粗产品中水合肼的质量分数为______。
(8)判断下列操作对测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制碘标准溶液时,烧杯中的溶液有少量溅出,则测定结果___________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果___________。
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化