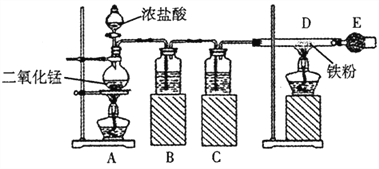
题目内容
【题目】将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是( )
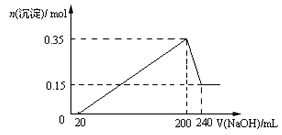
A. Mg和Al的总质量为9g
B. 最初20mLNaOH溶液用于中和过量的稀硫酸
C. NaOH溶液物质的量浓度为5mol·L-1
D. 生成的氢气在标准状况下的体积为11.2L
【答案】D
【解析】试题分析:从图象中看到,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后有剩余,此时发生的反应为:H2so4+2NaOH=Na2so4+2H2O.当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3;
A、当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2,n(Mg)=n[Mg(OH)2]=0.15mol,
m(Mg)=0.15mol×24gmol-1=3.6g,n(Al)=n[Al(OH)3]=0.35mol-0.15mol=0.2mol,m(Al)=0.2mol×27gmol-1=5.4g,所以镁和铝的总质量为9g,A项正确,B项正确。C.从200mL到240mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,则此过程消耗n(NaOH)=n[Al(OH)3]=0.2mol,c(NaOH)="0.2mol÷0.04" L=5molL-1,C项正确;D、由Mg+H2so4=Mgso4+H2↑,2Al+3H2so4=2Al2(so4)3+3H2↑可以计算出生成n(H2)=0.45mol,标准状况下V(H2)=0.45mol×22.4Lmol-1=10.08L,D项错误。答案选D。

【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为;
(2)反应是反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 .
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),试判断此时的温度为℃