��Ŀ����
����Ŀ��������ˮ�п��ܴ��ڵ���ƽ�⡢�ε�ˮ��ƽ��ͳ������ܽ�ƽ�⣬���Ƕ��ɿ�����ѧƽ�⣮
�������ѧ֪ʶ�Ļش�
��1��Ũ��Ϊ0.1mol/L��8����Һ����HNO3 ��H2SO4��HCOOH ��Ba��OH��2��NaOH ��CH3COONa ��KCl ��NH4Cl ��ҺpHֵ��С�����˳���ǣ���д��ţ� ��
��2��BΪ0.1molL��1NaHCO3��Һ��ʵ����NaHCO3��Һ��pH��7���������ӷ���ʽ��ʾ��ԭ�� ��
��3����0.10molL��1����ͭ��Һ�м�����������ϡ��Һ��ֽ�����dz��ɫ������ͭ�������ɣ�����Һ��pH=8ʱ��c��Cu2+��=����֪Ksp[Cu��OH��2]=2.2x10��20��������0.10molL��1����ͭ��Һ��ͨ�����H2S���壬ʹCu2+��ȫ����ΪCuS����ʱ��Һ�е�H+Ũ���ǣ�
���𰸡�
��1���ڢ٢ۢ�ߢޢݢ�
��2��HCO3+H2O?H2CO3+OH��
��3��2.2��10��8mol?L��1
���������⣺��1�����ڼ��Ϊ����Ba��OH��2��NaOH��Ũ����ͬʱ�����Ԣܣ��ݣ�ˮ��ʼ��Ե�Ϊ����CH3COONa����ˮ��̶Ƚ�С����pH���ܣ��ݣ��ޣ�
��Һ�����Ե�Ϊ����KCl��
��Һ�����Ե��У��٢ڢۢ࣬���Т�ΪһԪǿ�ᣬ��Ϊ��Ԫǿ�ᣬ��Ϊ���ᣬ��ˮ������ԣ�Ũ����ͬʱ��
��Һ��pH���ڣ��٣��ۣ��࣬
�ۺ����Ϸ�����֪����Һ��pH��С�����˳����Ϊ���ڢ٢ۢ�ߢޢݢܣ�
���Դ��ǣ��ڢ٢ۢ�ߢޢݢܣ���2����NaHCO3��Һ�д���̼��������ӵ�ˮ��ƽ��Ϊ��HCO3+H2OH2CO3+OH�� �� ����ƽ��Ϊ��HCO3��H++CO32�� �� ����ˮ��Ϊ������̼��������ӵ�ˮ��̶ȴ��ڵ���̶���Һ�����Լ��ԣ�
���Դ��ǣ�HCO3+H2OH2CO3+OH������3���������Cu��OH��2���ܶȻ�����ȷ��pH=8ʱ��c��OH����=10��6mol/L��Ksp[Cu��OH��2]=2.2��10��20 �� ��c��Cu2+��= ![]() =2.2��10��8molL��1��
=2.2��10��8molL��1��
��0.1molL��1����ͭ��Һ��ͨ�����H2S���壬ʹCu2+��ȫ����ΪCuS����ʱ��Һ�е�����Ϊ���ᣬc��SO42�������䣬Ϊ0.1molL��1 �� �ɵ���غ��֪c��H+��Ϊ0.2molL��1 ��
���Դ��ǣ�2.2��10��8molL��1��0.2molL��1 ��

 ���б�ˢ��ϵ�д�
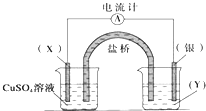
���б�ˢ��ϵ�д�����Ŀ��Ϊ̽��Cl2��Br2��Fe3+��������ǿ����ij��ѧ��ȤС�����������ʵ����

��1����A����������װ�����䷴Ӧ�����ӷ���ʽ��__________________________________��
��Bװ�õ�������_________________________��Cװ�õ�������_______________________������ʵ��װ�ô���һ�����Բ��㣬��ָ��_______________________________________________________��
��2���ø������װ�ý���ʵ�顣ʵ��������£�
ʵ����� | ʵ������ |
����a����Բ����ƿ�е�������Ũ���ᣬȻ��رջ���a����ȼ�ƾ��� | Dװ���У���Һ��� Eװ���У� ��ˮ����Һ��ƣ�CCl4�����Ա仯 |
��������Ũ���ᣬD��E�о��������µı仯��
Dװ���У���ɫ������ȥ��Eװ���У�CC14��������ɫ��Ϊ��ɫ������ɫ��ɺ�ɫ��
Ϊ̽������ʵ������ı��ʣ�С��ͬѧ����������£�
I��(SCN)2 ������±�����ƣ�������Cl2����(SCN)2����SCN-�ĵ���ʽΪ![]()
II��AgClO��AgBrO ��������ˮ
����Cl2 ��Br2��Ӧ����BrCl��BrCl�ʺ�ɫ���е�ԼΪ5������ˮ����ˮ�ⷴӦ
��С��ͬѧ��ΪDװ���к�ɫ��ȥ��ԭ��������SCN-��Cl2��������һ������̼Ԫ�ر�����������������__________________________________________��
������ʵ��֤ʵ��С��ͬѧ�Ʋ�ĺ����ԣ�����ƽ���ƶ�ԭ������Cl2����ʱD����Һ��ɫ��ȥ��ԭ��__________________________________________��
����̽��E �м����μ�Ũ�������ɫ�仯��ԭ�����ʵ���������÷�Һ©�������E���²���Һ�������ռ���ɫ���ʣ�ȡ����������AgNO3��Һ������۲쵽���а�ɫ�������������ϻ�ѧ������ͽ�������ɫ������ԭ��_________________________________________________��