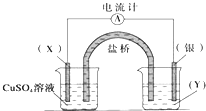
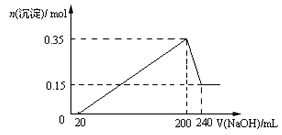
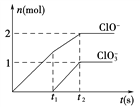
题目内容
【题目】将足量的CO2气体通入下列澄清溶液中,最终仍为澄清溶液的是( )
A. 偏铝酸钠溶液 B. 氯化钡溶液 C. 含有氨水的NaCl饱和溶液 D. 饱和Na2CO3溶液
【答案】B
【解析】A,足量CO2通入偏铝酸钠溶液中发生反应:CO2+NaAlO2+2H2O=NaHCO3+Al(OH)3↓,Al(OH)3不溶于H2CO3,最终有白色浑浊;B,由于酸性:HCl![]() H2CO3,CO2通入BaCl2溶液中不反应,无明显现象,最终仍为澄清溶液;C,足量CO2通入含有氨水的NaCl饱和溶液中发生反应:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,最终有白色NaHCO3晶体析出;D,足量CO2通入饱和Na2CO3溶液中发生反应:CO2+Na2CO3+H2O=2NaHCO3,由于同温下NaHCO3的溶解度小于Na2CO3,且反应中消耗H2O,最终有白色NaHCO3晶体析出;最终仍为澄清溶液的是BaCl2溶液,答案选B。
H2CO3,CO2通入BaCl2溶液中不反应,无明显现象,最终仍为澄清溶液;C,足量CO2通入含有氨水的NaCl饱和溶液中发生反应:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,最终有白色NaHCO3晶体析出;D,足量CO2通入饱和Na2CO3溶液中发生反应:CO2+Na2CO3+H2O=2NaHCO3,由于同温下NaHCO3的溶解度小于Na2CO3,且反应中消耗H2O,最终有白色NaHCO3晶体析出;最终仍为澄清溶液的是BaCl2溶液,答案选B。

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目