题目内容
15.2SO2(g)+O2(g) $?_{△}^{V_{2}O_{5}}$ 2SO3(g)△H<0是制备硫酸的重要反应.下列叙述正确的是( )| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 当v(SO2):v(O2):v(SO3 )=2:1:2时,反应达到平衡状态 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均反应速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
分析 A、催化剂可以同等程度的增大正、逆反应的反应速率;
B、不同物质的正逆反应速率之比等于计量数之比时,反应达到平衡状态;
C、降低温度,化学反应速率减小;
D、根据v=$\frac{△c}{△t}$计算判断.
解答 解:A、催化剂可以同等程度的增大正、逆反应的反应速率,则催化剂V2O5能增大该反应的逆反应速率,故A错误;
B、不同物质的正逆反应速率之比等于计量数之比时,反应达到平衡状态,v(SO2):v(O2):v(SO3 )=2:1:2,没有说明正逆反应速率,则不能说明达到平衡状态,故B错误;
C、降低温度,化学反应速率减小,延长了反应达到平衡的时间,故C错误;
D、根据计算平均速率的定义公式,浓度变化量c2-c1,时间为t2-t1,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$,故D正确;
故选:D.
点评 本题主要考查了影响化学反应速率和化学平衡的因素、平衡状态的判断、反应速率的计算等,题目难度中等,化学平衡的计算及影响因素、化学平衡常数的表达式及其计算是高考的重点,注意归纳总结.

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
5. 质子交换膜燃料电池(proton exchange membrane fuel cell,英文简称PEMFC)是燃料电池的一种.如图是质子交换膜氢氧燃料电池,下列有关该电池的原理的描述正确的是( )
质子交换膜燃料电池(proton exchange membrane fuel cell,英文简称PEMFC)是燃料电池的一种.如图是质子交换膜氢氧燃料电池,下列有关该电池的原理的描述正确的是( )
 质子交换膜燃料电池(proton exchange membrane fuel cell,英文简称PEMFC)是燃料电池的一种.如图是质子交换膜氢氧燃料电池,下列有关该电池的原理的描述正确的是( )
质子交换膜燃料电池(proton exchange membrane fuel cell,英文简称PEMFC)是燃料电池的一种.如图是质子交换膜氢氧燃料电池,下列有关该电池的原理的描述正确的是( )| A. | 溶液中H+透过质子交换膜从右向左迁移 | |
| B. | 正极反应式为:O2+2H2O+4e-=4OH- | |
| C. | 电子从a极流出经电解质溶液流到b极 | |
| D. | 该电池在使用过程中,H+的物质的量保持不变 |
6.下列有关浓硫酸和亚硫酸钠混和放出的气体的说法中不正确的是( )
| A. | 它与氧气接触即转变为SO3 | |
| B. | 亚硫酸钙能溶解于它的水溶液中 | |
| C. | 它的密度比空气小,且不易液化 | |
| D. | 它的水溶液是酸性,且能被强氧化剂氧化 |
3.下列关于苯酚的叙述中,错误的是( )
| A. | 碳酸氢钠溶液中滴入苯酚的水溶液后不会放出二氧化碳 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 其水溶液显强酸性,俗称石炭酸 |
7.下列事实中,能用勒夏特列原理解释的是( )
| A. | 对于反应2HI(g)?H2(g)+I2(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 | |
| B. | 实验室常用排饱和食盐水法收集氯气 | |
| C. | 硫酸工业中,加催化剂有利于三氧化硫的生成 | |
| D. | 2SO2+O2$?_{加热}^{催化剂}$2SO3的反应条件不是室温,是500℃左右 |
4.某元素的结构示意图如图所示,该元素在周期表中位于第几周期,( )
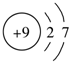

| A. | 一 | B. | 二 | C. | 三 | D. | 四 |
5.很多地区连日雾霾天气的罪魁祸首之一是PM2.5,2012年2月,国务院同意发布新修订的《环境空气质量标准》增加了PM2.5监测指标.下面关于PM2.5的说法中不正确的是( )
| A. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物 | |
| B. | PM2.5只是地球大气成分中含量很少的组分,对空气质量和能见度等没什么影响 | |
| C. | PM2.5粒径小,富含大量的有毒、有害物质且在大气中的停留时间长、输送距离远 | |
| D. | PM2.5主要来自化石燃料的燃烧(如机动车尾气、燃煤)、挥发性有机物等 |


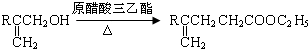
 .
.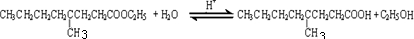 .
.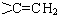 的同分异构体有12种.
的同分异构体有12种.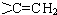 ,核磁共振氢谱有3个峰,且峰面积之比为9:2:1的同分异构体的结构简式为
,核磁共振氢谱有3个峰,且峰面积之比为9:2:1的同分异构体的结构简式为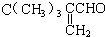 .
.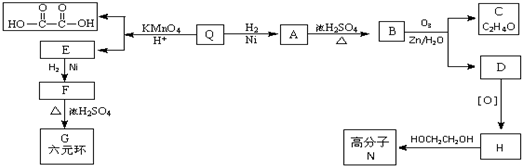
 ;Q的反式结构简式是
;Q的反式结构简式是 .
. .
.