题目内容
18.下列说法正确的一组是( )①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
③氯化钠水溶液在电流的作用下电离出Na+和Cl-,所以氯化钠是强电解质
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤熔融的电解质都能导电
⑥强电解质可能是离子化合物,也可能是共价化合物.
| A. | ①③⑤⑥ | B. | ②④⑤⑥ | C. | 只有⑤ | D. | 只有⑥ |
分析 ①电解质的强弱与溶解性无关;
②电解质:在水溶液中或熔融状态下能够导电的化合物;非电解质:在熔融状态和水溶液中都不能导电的化合物;
③氯化钠为电解质,在水溶液中能够电离出钠离子和氯离子,电离时不需要通电;
④H+浓度与酸的浓度、分子中氢离子的个数以及电离程度有关,与电解质的强弱无关;
⑤酸在熔融态时不导电;
⑥强电解质不一定是离子化合物,如氯化氢是共价化合物,它是强电解质,弱电解质也不一定是共价化合物,如氢氧化铝是弱电解质,但它是离子化合物.
解答 解:①电解质的强弱与溶解性无关,不溶于水的盐可能是强电解质,CaCO3、BaSO4均是强电解质,故①错误;
②二氧化碳溶于水能部分电离,但二氧化碳自身不能电离,故二氧化碳属于非电解质,故②错误;
③氯化钠水溶液不需要电流,而是在溶液中水的作用下能够电离出Na+和Cl-,故③错误;
④强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度,H+浓度与酸的浓度、分子中氢离子的个数以及电离程度有关,与电解质的强弱无关,故④错误;
⑤酸为共价化合物,在熔融态时均不导电,只有溶于水时才导电,故⑤错误;
⑥强电解质不一定是离子化合物,如氯化氢是共价化合物,它是强电解质,弱电解质也不一定是共价化合物,如氢氧化铝是弱电解质,但它是离子化合物,强电解质可能是离子化合物,也可能是共价化合物,故⑥正确,
故选D.
点评 本题主要考查的是强弱电解质的概念以及判断,涉及溶液导电的原因、溶液中离子浓度大小比较等,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列物质中,属于共价化合物的是( )
| A. | CaO | B. | N2 | C. | Na2O2 | D. | H2O |
9.下列物质中,只含有非极性共价键的是( )
| A. | Na2O2 | B. | NaOH | C. | O3 | D. | H2S |
6.下列有关浓硫酸和亚硫酸钠混和放出的气体的说法中不正确的是( )
| A. | 它与氧气接触即转变为SO3 | |
| B. | 亚硫酸钙能溶解于它的水溶液中 | |
| C. | 它的密度比空气小,且不易液化 | |
| D. | 它的水溶液是酸性,且能被强氧化剂氧化 |
3.下列关于苯酚的叙述中,错误的是( )
| A. | 碳酸氢钠溶液中滴入苯酚的水溶液后不会放出二氧化碳 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 其水溶液显强酸性,俗称石炭酸 |
7.下列事实中,能用勒夏特列原理解释的是( )
| A. | 对于反应2HI(g)?H2(g)+I2(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 | |
| B. | 实验室常用排饱和食盐水法收集氯气 | |
| C. | 硫酸工业中,加催化剂有利于三氧化硫的生成 | |
| D. | 2SO2+O2$?_{加热}^{催化剂}$2SO3的反应条件不是室温,是500℃左右 |
8.下列变化可通过一步实验直接完成的是( )
| A. | Al(OH)3→Al2O3 | B. | Al2O3→Al(OH)3 | C. | Al→Al(OH)3 | D. | SiO2→H2SiO3 |



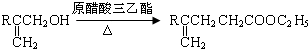
 .
.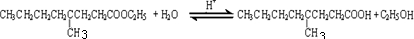 .
.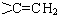 的同分异构体有12种.
的同分异构体有12种.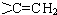 ,核磁共振氢谱有3个峰,且峰面积之比为9:2:1的同分异构体的结构简式为
,核磁共振氢谱有3个峰,且峰面积之比为9:2:1的同分异构体的结构简式为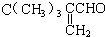 .
.