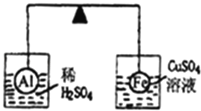
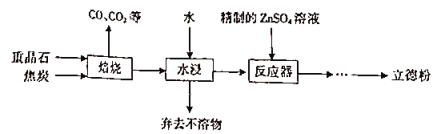
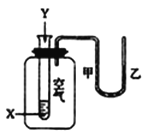
题目内容
【题目】下列说法正确的是( )
A. 用电子式表示氯化氢分子的形成过程:![]()
B. 二氧化硅熔点高于二氧化碳是因为其分子间作用力更大
C. 吸热反应一定要加热才能发生
D. 需要加热才能发生的反应不一定是吸热反应
【答案】D
【解析】
用电子式表示物质的形成过程需区分离子键或共价键;影响熔点的主要因素是构成粒子间的相互作用的强弱;吸热或放热反应与是否加热无必然关系。
A项:氯化氢是共价化合物,形成氯化氢分子时,氢氯原子间形成共用电子对而不发生电子得失,用电子式表示HCl的形成过程为![]() →
→![]() ,A项错误;
,A项错误;
B项:二氧化硅是原子晶体,原子间是共价键结合,而干冰是分子晶体,分子间是范德华力结合,共价键的键能远大于范德华力,故二氧化硅的熔点高于二氧化碳,B项错误;
C项:吸热反应的发生不一定要加热,如Ba(OH)2·8H2O与NH4Cl的反应为吸热反应,常温就能发生,C项错误;
D项:燃烧反应都是放热反应,但通常要加热使温度达到着火点,D项正确。
本题选D。

【题目】氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂。
回答下列问题:
(1)①一氯胺(NH2Cl)的电子式为__________。
②工业上可利用反应Cl2(g)+NH3(g)=NH2Cl(l)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的链能相同),则该反应的△H=______________。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
③一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为_________________。
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol C12和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(g)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol C12和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①甲容器中,0~40 min内用NH3的浓度变化表示的平均反应速率v(NH3)=______________。
②该反应的△H________0(填“>”或“<”) ,理由是____________________。
③对该反应,下列说法正确的是______________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内C12和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NHCl2,平衡向逆反应方向移动
(3)在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl
NHCl2(l)+2HCl(g),测得平衡时Cl

①A、B、C三点中Cl2转化率最高的是______点(填“A”“B”或“C”)。
②计算C点时该反应的压强平衡常数Kp(C)=_______(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)