题目内容
【题目】工业上采用FeSO4和NaOH为主要原料、在碱性条件下通入空气氧化沉淀制备铁磁粉Fe3O4,其原理如下:
①FeSO4 +2NaOH==Fe(OH)2↓ +Na2SO4
②4Fe(OH)2+O2 +2H2O= =4Fe(OH)3↓
③Fe(OH)2+2Fe(OH)3![]() Fe3O4+4H2O
Fe3O4+4H2O
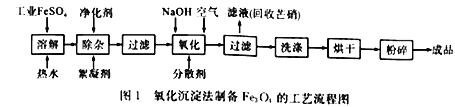
硫酸亚铁在不同温度下的溶解度:
温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
I.(问题讨论)
(1)溶解时,所用热水的温度约为___________,目的是_______________________________________。
(2)副产品芒硝的化学式是_______________________。
(3)为了检验产品是否洗涤干净,需要进行的实险操作是________________________________。
II.(组成确定)
资料显示:①铁的氯氧化物在受热时分解生成铁的氧化物(化合价不变);
②Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4 ,再生成FeO(黑色),最后生成Fe。
为确定用以上方法制得的产品的纯度,称取23.28g该样品利用图2装置进行实验探究。
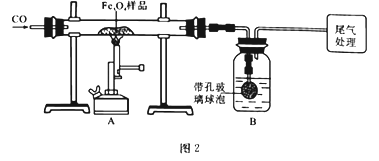
(1)该组同学欲通过称量B装置反应前后的质量变化来计算并确认该样品中的杂质。B中的最佳试剂是________(填字母),B中带孔玻璃球泡的作用是____________________________________。
A.澄清石灰水 B.氢氧化钠浓溶液 C.稀盐酸 D.水
(2)上述实验过程中,CO气体除作为反应物外,能起到的作用还有:
①实验开始时,排尽装置中的空气,防止加热时发生爆炸;
②停止加热后,继续通CO气体,防止生成物被氧化,防止B中的溶液倒吸入A中,还可以_______,以提高实验的精确度。
(3)利用仪器测定并绘制出反应过程中A装置中玻璃管内的固体质量随温度的变化曲线,如图3:

①样品中含有的杂质成分是_____________________(填化学式)。
②样品中杂质的质量分数为_____ %(保留2位小数)。
【答案】 60℃ 该温度时硫酸亚铁的溶解度较大,增大其溶解量 Na2SO4·10H2O 取最后一次洗涤的滤液于试管中,先加入盐酸酸化再加入BaCl2溶液,若无白色沉淀,说明已经洗涤干净 B 使液体与气体充分接触 将产生的CO2全部赶入装置B中 Fe2O3 10.31
【解析】(1) 根据FeSO4的溶解度表可知,50℃至80℃时FeSO4的溶解度较大,其它温度下溶解度较小,不利于溶解,溶解时,所用热水的温度约为60℃为宜,控制温度为60℃的目的是该温度时硫酸亚铁的溶解度较大,增大其溶解量;正确答案:60℃;该温度时硫酸亚铁的溶解度较大,增大其溶解量。
(2) FeSO4与NaOH反应除了生成Fe(OH )2,还生成Na2SO4,故副产物芒硝化学式是Na2SO4·10H2O;正确答案:Na2SO4·10H2O。
(3) 沉淀的成分为Fe(OH)2和Fe(OH)3,其中含有杂质Na2SO4,要得到纯净的产品,必须将沉淀洗涤干净,因此过滤、洗涤后进行的操作过程为:取最后一次洗涤的滤液于试管中,加入盐酸酸化的BaCl2溶液,若无白色沉淀,说明已经洗涤干净;正确答案:取最后一次洗涤的滤液于试管中,先加入盐酸酸化再加入BaCl2溶液,若无白色沉淀,说明已经洗涤干净。
II. (1)CO和Fe3O4反应生成CO2气体,吸收CO2气体的最好的试剂为NaOH溶液,故B中的最佳试剂为NaOH;B中带孔玻璃球泡的作用是使液体与气体充分接触,有利于充分反应;正确答案:B;使液体与气体充分接触。
(2)CO还可以将产生的CO2气体全部赶入装置B中,提高实验的准确率;正确答案:将产生的CO2全部赶入装置B中。
(3)①若样品中只有Fe3O4,加热过程中固体质量下降应只有两段,而现在样品的质量下降有三段,故样品中除了Fe3O4外还有其他成分,沉淀M为Fe(OH)2和Fe(OH)3的混合物,加热时除生成Fe3O4外,Fe(OH)3加热分解能生成Fe2O3,故Fe3O4样品中含有的杂质成分为Fe2O3;正确答案:Fe2O3 。
②设Fe2O3和Fe3O4的物质的量分别为x、y,根据铁原子守恒有2x+3y=(16.80/56)mol =0.3mol,根据质量有:160x+232y=23.28,所以解得y=0.09mol,故样品中Fe3O4的质量分数=0.09×232g÷23.28g×100%=89.69%,样品中杂质Fe2O3的质量分数为1-89.69%=10.31%;正确答案:10.31。