题目内容
【题目】(1)由工业合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,涉及以下四个可逆反应:
甲醇合成反应:
(i)CO(g) +2H2(g)==CH3OH(g) △H 1=-90.1kJ·mol-1;
(ii)CO2(g)+3H2(g)== CH3OH(g) +H2O(g) △H2=-49.0kJ·mol-1;
水煤气变换反应:(iii)CO(g)+ H2O(g)==CO2(g)+ H2(g) △H3=-41.1kJ·mol-1;
二甲醚合成反应:(iv)2CH3OH(g) ==CH3OCH3(g)+ H2O(g) △H4=-24.5kJ·mol-1;
①由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为____________________________。根据化学反应原理,分析增大压强对直接制备二甲醚反应的影响:___________________________________。
②反应( ii )的平衡常数表达式为K=______________。
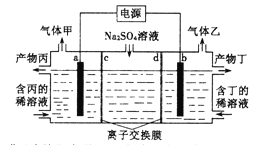
(2)现以二甲醚燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72-),实验室利用如图2装置模拟该法:

①M电板(a为CO2)的电极反应式为________________________;电解池阳极的电极反应式为_______________________________________。
②请写出电解池中Cr2O72-转化为Cr3+的离子反应方程式:__________________________。
③已知25 ℃时,Ksp[Cr(OH)3]=6.4×10-31。一般以离子浓度≤1×10-5 mol/L作为该离子除尽的标准。处理废水时,最后Cr3+以Cr(OH)3形式除去,当溶液的pH=6时,c(Cr3+)=______,Cr3+ ___ (填“是”或“否”)被除尽。
【答案】 2CO(g)+4H2(g)==CH3OCH3(g)+H2O(g)△H =-204.7kJ·mol-1 压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加,另外压强升高使CO和H2浓度增加,反应速率增大 c(CH3OH)c(H2O)/c(CO2)c3(H2) CH3OCH3+3H2O-12e-=2CO2+12H+ Fe-2e-=Fe2+ Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O 6.4×10-7mol/L 是
【解析】(1)(i)CO(g)+2H2(g)==CH3OH(g)△H1=-90.1kJ·mol-1; (iv)2CH3OH(g)==CH3OCH3(g)+H2O(g)△H4=-24.5kJ·mol-1;根据盖斯定律:i×2+iv得到:2CO(g)+4H2(g)==CH3OCH3(g)+H2O(g)△H =-204.7kJ·mol-1;该反应是气体体积减小的反应,增加压强平衡正向进行,反应速率增大,CO和H2转化率增大,CH3OCH3产率增加,另外压强升高使CO和H2浓度增加,反应速率增大;正确答案: CO(g)+4H2(g)==CH3OCH3(g)+H2O(g)△H =-204.7kJ·mol-1;压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加,另外压强升高使CO和H2浓度增加,反应速率增大。
②(ii)CO2(g)+3H2(g)== CH3OH(g)+H2O(g)△H2=-49.0kJ·mol-1;反应(ii)的平衡常数表达式为K=c(CH3OH)c(H2O)/c(CO2)c3(H2);正确答案:c(CH3OH)c(H2O)/c(CO2)c3(H2)。
(2) ①根据氢离子移动方向,M电板为原电池的负极,甲醚发生氧化反应产生CO2,电极反应式为:CH3OCH3+3H2O-12e-=2CO2+12H+;金属铁做阳极,失电子,发生氧化反应, 电极反应式为:Fe-2e-=Fe2+;正确答案:CH3OCH3+3H2O-12e-=2CO2+12H+;Fe-2e-=Fe2+。
②阳极铁失电子变为亚铁离子,具有还原性,被Cr2O72-氧化为铁离子,Cr2O72-本身还原为Cr3+,离子反应方程式: Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O;正确答案:Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O。
③当溶液的pH=6时,c(H+)=10-6mol/L,c(OH-)=10-8mol/L,Ksp[Cr(OH)3]= c(Cr3+)×c3(OH-)=6.4×10-31, c(Cr3+)=6.4×10-31/(10-8)3=6.4×10-7mol/L,如果以离子浓度≤1×10-5mol/L作为该离子除尽的标准,6.4×10-7mol/L<1×10-5mol/L,Cr3+是被除尽;正确答案:6.4×10-7mol/L ;是。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
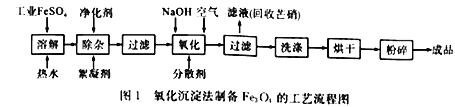
活力试卷系列答案【题目】工业上采用FeSO4和NaOH为主要原料、在碱性条件下通入空气氧化沉淀制备铁磁粉Fe3O4,其原理如下:
①FeSO4 +2NaOH==Fe(OH)2↓ +Na2SO4
②4Fe(OH)2+O2 +2H2O= =4Fe(OH)3↓
③Fe(OH)2+2Fe(OH)3![]() Fe3O4+4H2O
Fe3O4+4H2O
硫酸亚铁在不同温度下的溶解度:
温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
I.(问题讨论)
(1)溶解时,所用热水的温度约为___________,目的是_______________________________________。
(2)副产品芒硝的化学式是_______________________。
(3)为了检验产品是否洗涤干净,需要进行的实险操作是________________________________。
II.(组成确定)
资料显示:①铁的氯氧化物在受热时分解生成铁的氧化物(化合价不变);
②Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4 ,再生成FeO(黑色),最后生成Fe。
为确定用以上方法制得的产品的纯度,称取23.28g该样品利用图2装置进行实验探究。
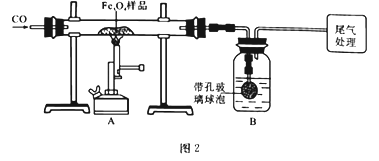
(1)该组同学欲通过称量B装置反应前后的质量变化来计算并确认该样品中的杂质。B中的最佳试剂是________(填字母),B中带孔玻璃球泡的作用是____________________________________。
A.澄清石灰水 B.氢氧化钠浓溶液 C.稀盐酸 D.水
(2)上述实验过程中,CO气体除作为反应物外,能起到的作用还有:
①实验开始时,排尽装置中的空气,防止加热时发生爆炸;
②停止加热后,继续通CO气体,防止生成物被氧化,防止B中的溶液倒吸入A中,还可以_______,以提高实验的精确度。
(3)利用仪器测定并绘制出反应过程中A装置中玻璃管内的固体质量随温度的变化曲线,如图3:

①样品中含有的杂质成分是_____________________(填化学式)。
②样品中杂质的质量分数为_____ %(保留2位小数)。