题目内容
9.CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.(1)SO2、NOx是形成酸雨和光化学烟雾的环境污染性气体,研究发现,空气中少量的 NO2
能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2=SO3+NO ②SO3+H2O=H2SO4 ③2NO+O2=2NO2.
则MnO2在下述变化中的作用与NO2在上述过程中的作用相似的是BC(填选项)
A.实验室用MnO2和浓盐酸混合加热制氯气
B.实验室用氯酸钾和MnO2混合加热制氧气
C.双氧水加入MnO2制氧气
D.高锰酸钾受热分解为二氧化锰、锰酸钾和氧气
(2)请写出用上述选项A实验室制氯气反应的离子方程式MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,若利用B和C制备等量的氧气,则转移的电子数目之比为2:1.
(3)很多现代化的纯碱厂,纯碱生产工艺仍沿用我国化学家侯德榜改进的纯碱生产工艺,其生产流程可简要表示如下:
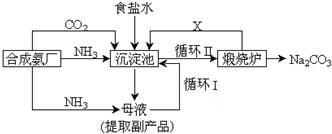
①上述生产纯碱的方法称侯德榜制碱法,沉淀池中发生的化学反应方程式是NH3+CO2+H2O+NaCl═NH4Cl+NaHCO3↓.
②检验产品碳酸钠中是否含有氯化钠的操作方法为取少量试样溶于水,加入过量的稀硝酸,再滴加硝酸银溶液,观察最终是否有沉淀生成.
③写出上述流程中X物质的分子式CO2,副产品的一种用途为化肥或电解液或电焊去锈剂.
④使原料氯化钠的利用率从70%提高到90%以上,主要是设计了循环I(填上述流程中的编号)的循环.
⑤向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有AC.
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度.
分析 (1)根据二氧化氮作反应物时化合价的变化及在整个反应中所起的作用分析;
(2)氯酸钾分解反应的方程式为2KClO3$\frac{\underline{\;MnO_{2}\;}}{\;}$2KCl+3O2↑,转移电子是12mol;2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,转移电子是2mol;
(3)①沉淀得到的是碳酸氢钠晶体,反应式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;
②检验产品碳酸钠中是否含有氯化钠即检验是否含氯离子,可以用硝酸酸化的硝酸银;
③循环Ⅱ是利用碳酸氢钠分解生成的二氧化碳通入沉淀池循环使用;生产纯碱的方法中副产品是氯化铵;
④乙流程关系分析,反应过程中氯化钠可以循环利用,提高原料利用率;
⑤向母液中通氨气,溶液中的铵根离子浓度增大有利于氯化铵晶体析出,可以是碳酸氢钠转化为溶解度更大的碳酸钠,提高氯化铵的纯度.
解答 解:(1)①SO2+NO2=SO3+NO,该反应二氧化氮中氮元素的化合价降低,所以二氧化氮作氧化剂;
将方程式①×2+②+③得方程式为:2SO2+H2O+O2=SO3+H2SO4,所以二氧化氮在整个反应过程中起催化剂的作用.
A.用MnO2和浓盐酸混合加热制氯气,二氧化锰做氧化剂,故A错误;
B.用氯酸钾和MnO2混合加热制氧气,二氧化锰做催化剂,故B正确;
C.双氧水加入MnO2制氧气,二氧化锰做催化剂,故C正确;
D.高锰酸钾受热分解为二氧化锰、锰酸钾和氧气,二氧化锰是生成物,故D错误.
故答案为:BC;
(2)实验室制氯气反应的离子方程式MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;氯酸钾分解反应的方程式为2KClO3$\frac{\underline{\;MnO_{2}\;}}{\;}$2KCl+3O2↑,转移电子是12mol;2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,转移电子是2mol,当获得氧气的质量均是32g,即1mol时,转移电子数分别是4mol、2mol,所以所转移的电子数目之比是2:1,故答案为:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;2:1;
(3)①沉淀池中发生的化学反应为饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,故答案为:NH3+CO2+H2O+NaCl═NH4Cl+NaHCO3↓;
②检验产品碳酸钠中是否含有氯化钠即检验是否含氯离子,可以用硝酸酸化的硝酸银,观察到若产生白色沉淀则说明有氯化钠存在,若不生成沉淀,则无氯化钠,故答案为:取少量试样溶于水,加入过量的稀硝酸,再滴加硝酸银溶液,观察最终是否有沉淀生成;
③在联合制碱法中二氧化碳是反应的原料同时也是反应的副产物,可以循环利用;上述生产纯碱的方法中副产品是氯化铵,它的一种用途为:是一种很好的氮肥,也可用作焊药或电解液,故答案为:CO2;化肥或电解液或电焊去锈剂;
④因为氯化钠最后剩余在母液中,所以循环I是氯化钠的循环,故答案为:循环I;
⑤氨气溶于水后生成氨水,氨水电离成铵根,增大铵根的浓度有利于氯化铵的析出来,所以选项A正确;
通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度所以选项C正确,选项B错误,故答案为:AC.
点评 本题考查化工流程,题目难度中等,必须对课本上的制碱法的反应原理和流程十分清楚,同时也考查了化学方程式的书写的技巧、实验过程分析与判断的能力.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案| A. | 2 L溶液中阴阳离子总数为1.2NA | |
| B. | 500 mL溶液中NO3-浓度为0.2 mol•L-1 | |
| C. | 500 mL溶液中Ba2+浓度为0.2 mol•L-1 | |
| D. | 500 mL溶液中NO3-物质的量为0.2 mol |
| A. | 7.2g CaO2晶体中阴离子和阳离子总数为0.3NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol放出热量9.2kJ时,转移电子0.6NA | |
| C. | 0.1mol/LNH4Cl溶液中Cl-离子数目为0.1NA | |
| D. | 0.1molH2O2分子中含极性共价键数目为0.3NA |
| A. | 22.4LN2中一定含有6.02×1023个氮分子 | |
| B. | 1LH2O中溶解了0.5molNaCl,则该溶液的物质的量浓度为0.5mol/L | |
| C. | 从1L1mol/LC12H22O11溶液中取出10mL,则取出的10mL溶液物质的量的浓度仍为1mol/L | |
| D. | 1LH2SO4溶液中含有98g H2SO4,则该溶液的物质的量浓度为98g/L |
| A. | 饱和石灰水 | B. | 氢硫酸 | C. | 碳酸氢钙溶液 | D. | 碳酸氢钠溶液 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 9:4:2 | B. | 11:5:3 | C. | 7:3:2 | D. | 3:1:1 |
