题目内容
3.工业上以废铜为原料经一系列化学反应可生产氯化亚铜(CuCl),其工艺流程如图K9-4所示:
试根据如图转化回答下列问题:
(1)工业生产Cl2时,尾气常用石灰乳吸收,而不用烧碱溶液吸收的原因是石灰乳来源丰富,成本低,且反应结束后可得副产品漂白粉.
(2)还原过程中的产物为Na[CuCl2],试写出反应的化学方程式CuCl2+2NaCl+Cu═2Na[CuCl2].
制备中当氯化完成后必须经还原过程再制得CuCl,为什么不用一步法制得CuCl?(已知Cu2++Cu+2Cl-═2CuCl↓)CuCl沉淀沉积在Cu表面阻碍反应的进行.
(3)还原过程中加入少量盐酸的作用是防止Cu2+水解,
加入NaCl且过量的原因是生成更多的Na[CuCl2],提高产率.
(4)合成结束后所得产品用酒精淋洗的目的是使CuCl尽快干燥,防止被空气氧化.
(5)实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,试写出该反应的离子方程式2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl+4H++SO42-.
分析 (1)从工业生产中所用原料的经济性的角度解答;
(2)流程分析可知,铜和氯气反应生成氯化铜,加入铜、氯化钠和盐酸还原得到产物为Na[CuCl2],结合原子守恒配平书写方程式;
(3)Cu2+水解呈酸性,加入盐酸能抑制其水解,生成Na[CuCl2]的反应中有氯离子参加,增加氯离子浓度促使反应正向进行;
(4)酒精酒精沸点低,易挥发,易晾干,所以即可以除去表面可溶性杂质又易干燥;
(5)氯化铜溶液中通入二氧化硫具有还原性,还原得到白色的CuCl沉淀,二氧化硫被氧化为硫酸.
解答 解:(1)石灰乳来源丰富,成本低,且反应结束后可得副产品漂白粉,所以工业生产Cl2时,尾气常用石灰乳吸收,而不用烧碱溶液吸收,
故答案为:石灰乳来源丰富,成本低,且反应结束后可得副产品漂白粉;
(2)流程分析可知,铜和氯气反应生成氯化铜,加入铜、氯化钠和盐酸还原得到产物为Na[CuCl2],结合原子守恒配平书写化学方程式为:CuCl2+2NaCl+Cu═2Na[CuCl2];制备中当氯化完成后必须经还原过程再制得CuCl的原因是CuCl沉淀沉积在Cu表面阻碍反应的进行;
故答案为:CuCl2+2NaCl+Cu═2Na[CuCl2];CuCl沉淀沉积在Cu表面阻碍反应的进行;
(3)Cu2+水解呈酸性,加入盐酸能抑制其水解,生成Na[CuCl2]的反应中有氯离子参加,增加氯离子浓度促使反应正向进行,生成更多的Na[CuCl2],提高产率,
故答案为:防止Cu2+水解;增大NaCl的浓度有利于生成更多的Na[CuCl2],提高产率;
(4)酒精酒精沸点低,易挥发,易晾干,所以即可以除去表面可溶性杂质又易干燥,防止被空气氧化,
故答案为:使CuCl尽快干燥,防止被空气氧化;
(5)氯化铜溶液中通入二氧化硫具有还原性,还原得到白色的CuCl沉淀,二氧化硫被氧化为硫酸,反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl+4H++SO42-,
故答案为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl+4H++SO42-.
点评 本题考查学生对元素及其化合物的主要性质的掌握、书写化学方程式、阅读题目获取新信息能力、对工艺流程的理解等,难度中等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力.

 阅读快车系列答案
阅读快车系列答案| A. | 饱和石灰水 | B. | 氢硫酸 | C. | 碳酸氢钙溶液 | D. | 碳酸氢钠溶液 |
| A. | 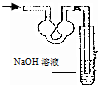 | B. | 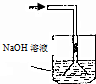 | C. | 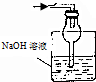 | D. | 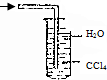 |
| A. | 实验室制氯气:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 实验室制二氧化硫:Cu+SO42-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H20 | |
| C. | 实验室用浓氨水与生石灰制氨气:NH3•H20═Ca(OH)2+NH3↑ | |
| D. | 实验室制二氧化氮:Cu+4H++2NO3-═Cu2++2NO2↑+2H20 |
| X | Y | |||
| Z | W | |||
| M |
| A. | M与Y可能形成M2Y3和M2Y5化合物 | |
| B. | 原子半径大小关系:Z>X>Y | |
| C. | 不能通过电解熔融Z、W组成的物质制备Z单质 | |
| D. | Y可以形成多种氢化物,其沸点均比X与H形成的化合物高 |
| A. | $\frac{pa}{m}$ | B. | $\frac{m}{pa}$ | C. | $\frac{ma}{p}$ | D. | $\frac{mp}{a}$ |
| A. | 9:4:2 | B. | 11:5:3 | C. | 7:3:2 | D. | 3:1:1 |
| X | Y | Z | |
| W |
| A. | 单质沸点:Z>W | |
| B. | 制备单质W常用的方法是电解其熔融氧化物 | |
| C. | Y、Z的某种氧化物均能与氢氧化钠溶液反应 | |
| D. | Z分别与W、X形成的化合物中化学键类型相同 |