��Ŀ����
����Ŀ��̼����Ԫ��������������������������������������
I.�ȵĻ��������ɡ�ת��һֱ����ѧ�о����ȵ���
��1��һ����������������������Ӧ�����Ʊ���̬�Ȱ���NH2Cl������֪���ֻ�ѧ���ļ���:
��ѧ�� | N-H | Cl-Cl | N-Cl | H-Cl |
����/KJmol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
��������Ӧ���Ȼ�ѧ����ʽΪ:__________________��
��2��������һ�ֳ�Ч���ͺ��������������������־õ�ɱ������������ɱ��H7N9�����в�����������ԭ��Ϊ��ˮ������Ӧ����ǿ�����Ե��������÷�Ӧ�Ļ�ѧ����ʽΪ_____________��
II.̼�Ļ������ת���������������о�����Ҫ��Ӧ�����ر���CO2�ĵ�̼ת�ͶԵ�������仯������Ҫ���塣
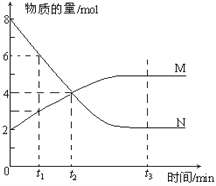
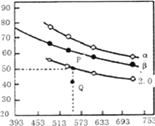
��3��������������Ϊ1L���ܱ��������Բ�ͬ����̼��![]() ����H2��CO2����һ�������·�����Ӧ��2CO2(g)+6H2(g)
����H2��CO2����һ�������·�����Ӧ��2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ��H��CO2��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ�������¡�2.0�ֱ����������̼��ʱ�ı仯���ߣ���
C2H4(g)+4H2O(g) ��H��CO2��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ�������¡�2.0�ֱ����������̼��ʱ�ı仯���ߣ���
��ش���������:
����Ӧ����H______0����̼����____�£�Q��v(��)_____v(��)���>����<������=����
������ʼʱ��CO2��Ũ���ֱ�Ϊ0.5mol/L���tP���Ӧ�¶��ȵ�ƽ�ⳣ����ֵΪ________��
��4����֪��̼�� H2CO3: K1=4.3��10-7��K2=5.6��10-11��
���� H2C2O4: K1=6.0��10-2��K2=6.0��10-5
�� ���������Դ����������_______(����ĸ)��
a.CO32-��HC2O4- b.H2CO3��C2O42- c. C2O42-��HCO3- d.H2C2O4��HCO3-
�����������ʵ���Ũ�ȵIJ�����Һ��̼����Һ�������ϣ���Һ����������(��OH-��)Ũ���ɴ�С��˳����_________��
���𰸡� NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g) ��H=+11.3kJ��mol-1 NH2Cl+H2O=NH3+HClO��NH2Cl+2H2O=NH3��H2O+HClO < > > 512 b c c(H+)>c(HC2O4-)>c(C2O42-)>c(HCO3-)>c(CO32-)
��������I����1��һ�������£������백����Ӧ�����Ȱ�(NH2C1)��HCl���壬�仯ѧ����ʽΪ��NH3+Cl2=NH2Cl+HCl����Ӧʱ�ɼ��Ķ�����Ҫ���ȣ��γ��µĻ�ѧ�����ȣ�����ݻ�ѧ���ļ��ܿ�֪��H=3��391.3 kJ/mol+243.0kJ/mol-2��391.3 kJ/mol-191.2kJ/mol-431.8 kJ/mol =+11.3kJ/mol����������Ӧ���Ȼ�ѧ����ʽΪ��NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g) ��H=+11.3kJ/mol����2���Ȱ���ˮ������ӦNH2-��ˮ���������H+��ϳɰ�����Cl+��OH-�������ǿ�����Ե�����HClO���÷�Ӧ�Ļ�ѧ����ʽΪNH2Cl+ H2O![]() NH3+HClO��NH2Cl+ 2H2O
NH3+HClO��NH2Cl+ 2H2O![]() NH3��H2O +HClO����3������ͼ���֪�������¶ȵ�����CO2��ת���ʽ��ͣ��������¶�ƽ�����淴Ӧ�����ƶ����淴Ӧ�������ȣ�����Ӧ������ȣ���HС��0����̼��Խ��CO2��ת����Խ����ͼ���֪����̼��
NH3��H2O +HClO����3������ͼ���֪�������¶ȵ�����CO2��ת���ʽ��ͣ��������¶�ƽ�����淴Ӧ�����ƶ����淴Ӧ�������ȣ�����Ӧ������ȣ���HС��0����̼��Խ��CO2��ת����Խ����ͼ���֪����̼��![]() ������̼��Ϊ2.0ʱ��Q���CO2��ת����С��P�㣬��Ӧ��������ҽ��У��ﵽƽ�⣬v(��)����v(��)����P��CO2��ƽ��ת����Ϊ50%��ƽ��ʱCO2��H2��C2H4��H2O��Ũ�ȷֱ�Ϊ0.25mol/L��0.25mol/L��0.125mol/L��0.5mol/L����ʱ
������̼��Ϊ2.0ʱ��Q���CO2��ת����С��P�㣬��Ӧ��������ҽ��У��ﵽƽ�⣬v(��)����v(��)����P��CO2��ƽ��ת����Ϊ50%��ƽ��ʱCO2��H2��C2H4��H2O��Ũ�ȷֱ�Ϊ0.25mol/L��0.25mol/L��0.125mol/L��0.5mol/L����ʱ![]() ����4���ٸ���̼��Ͳ���ĵ���ƽ�ⳣ����֪�����ԣ�H2C2O4> HC2O4- > H2CO3> HCO3-��a.CO32-��HC2O4-��Ӧ����HCO3-��C2O42-�����ܴ������棻b.H2CO3��C2O42-����Ӧ���ܴ������棻c. C2O42-��HCO3-����Ӧ���ܴ������棻d.H2C2O4��HCO3-��Ӧ����HC2O4-��CO2��H2O�����ܴ������棬��ѡbc���ڶ�Ԫ�����һ������ȵڶ�������ǿ�ö࣬����̼��Ͳ���ĵ���ƽ�ⳣ����֪�����������ʵ���Ũ�ȵIJ�����Һ��̼����Һ�������ϣ���Һ��������Ũ�������ĵڶ��������̼��ĵ�һ������̶ȴʸ�������(��OH����)Ũ���ɴ�С��˳���ǣ�c(H+)>c(HC2O4-)>c(C2O42-)>c(HCO3-)>c(CO32-)��
����4���ٸ���̼��Ͳ���ĵ���ƽ�ⳣ����֪�����ԣ�H2C2O4> HC2O4- > H2CO3> HCO3-��a.CO32-��HC2O4-��Ӧ����HCO3-��C2O42-�����ܴ������棻b.H2CO3��C2O42-����Ӧ���ܴ������棻c. C2O42-��HCO3-����Ӧ���ܴ������棻d.H2C2O4��HCO3-��Ӧ����HC2O4-��CO2��H2O�����ܴ������棬��ѡbc���ڶ�Ԫ�����һ������ȵڶ�������ǿ�ö࣬����̼��Ͳ���ĵ���ƽ�ⳣ����֪�����������ʵ���Ũ�ȵIJ�����Һ��̼����Һ�������ϣ���Һ��������Ũ�������ĵڶ��������̼��ĵ�һ������̶ȴʸ�������(��OH����)Ũ���ɴ�С��˳���ǣ�c(H+)>c(HC2O4-)>c(C2O42-)>c(HCO3-)>c(CO32-)��

 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�����Ŀ��ij�¶��£�0.200 molL-1��HA��Һ��0.200 molL-1��NaOH��Һ�������Ϻ�������Һ�в�������ּ�Ũ�����±�������˵����ȷ����
�� | X | Y | Na+ | A- |
Ũ��/��mol��L-1�� | 8.00 | 2.50 | 0.100 | 9.92 |
A. 0.1mol��L-1HA��Һ��pH=1 B. ���¶���Kw=1.0![]() 10-14
10-14
C. ��X��ʾOH-��Y��ʾH+ D. �����Һ�У�n��A-��+n��X��=n��Na+��