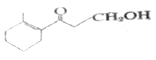
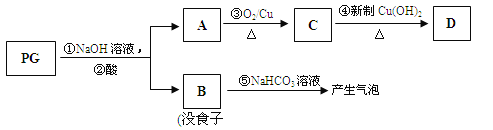
题目内容
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如下图,依图所示:
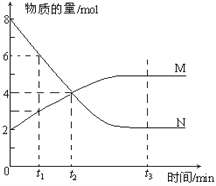
(1)该反应的化学方程式是_____________________。
(2)在图上所示的三个时刻中,_____(填t1、t2或t3)时刻处于平衡状态,此时V正____V逆(填>、<或=,);达到平衡状态后,平均反应速率v(N)﹕v(M)= _____。
(3)若反应容器的容积不变,则“压强不再改变”_______(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是_____(选填字母)。
A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
【答案】 2N![]() M (或M
M (或M![]() 2 N) t3 = 2﹕1 能 AD
2 N) t3 = 2﹕1 能 AD
【解析】(1)M物质的量增大、N的物质的量减小,故N为反应物、M为生成物,最终N的物质的量不变且不为0,则该反应属于可逆反应,△n(N)=8mol-2mol=6mol,△n(M)=5mol-2mol=3mol,则N、M的化学计量数之比为2:1,故反应方程式为:2NM;
(2)在t3时刻M、N的物质的量为定值,处于平衡状态,故在t3时刻v正=v逆,达到平衡状态后,平均反应速率v(N)﹕v(M)=2:1;
(3)反应方程式为:2NM,反应前后气体物质的量不相等,恒温恒容下,随反应想容器内压强发生变化,压强不变说明反应到达平衡;
(4)A.升高温度,反应速率加快,故A正确;B.降低压强,反应速率减慢,故B错误;C.减小M的浓度,反应速率减慢,故C错误;D.将反应容器体积缩小,压强增大,浓度增大,反应速率加快,故D正确,故选AD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】碳和氧元素及其化合物与人类的生产、生活密切相关。
I.氯的化合物合成、转化一直是科学研究的热点。
(1)一定条件下,氯气与氨气反应可以制备气态氯胺(NH2Cl),己知部分化学键的键能:
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/KJmol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
则上述反应的热化学方程式为:__________________。
(2)氯胺是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为_____________。
II.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。
(3)在三个容积均为1L的密闭容器中以不同的氢碳比![]() 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(α、β、2.0分别代表三种氢碳比时的变化曲线)。
C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(α、β、2.0分别代表三种氢碳比时的变化曲线)。
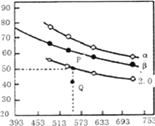
请回答下列问题:
①反应的△H______0,氢碳比α____β,Q点v(正)_____v(逆)(填“>”或“<”、“=”)
②若起始时,CO2的浓度分别为0.5mol/L,則P点对应温度度的平衡常数的值为________。
(4)己知:碳酸 H2CO3: K1=4.3×10-7、K2=5.6×10-11;
草酸 H2C2O4: K1=6.0×10-2、K2=6.0×10-5
① 下列微粒可以大量共存的是_______(填字母)。
a.CO32-、HC2O4- b.H2CO3、C2O42- c. C2O42-、HCO3- d.H2C2O4、HCO3-
②若将等物质的量浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子(除OH-外)浓度由大到小的顺序是_________。
【题目】(1)接触法制硫酸工艺中,其主反应是在恒容、温度为450℃并有催化剂存在的条件下进行:
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-190Kj/mol
2SO3(g) ΔH=-190Kj/mol
①下列描述中能说明上述反应已达平衡的是____________。
a. ![]() (O2)正=2
(O2)正=2![]() (SO3)逆 b.容器中气体的密度不随时间而变化
(SO3)逆 b.容器中气体的密度不随时间而变化
c.容器中气体的平均相对分子质量不随时间而变化 d.容器中气体的分子总数不随时间而变化
②在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则![]() (O2)=__________mol·L-1·min-1,若继续通入0.40 mol SO2和0.20molO2则平
(O2)=__________mol·L-1·min-1,若继续通入0.40 mol SO2和0.20molO2则平
衡______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol3) <_____mol。
(2)工业生成尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2(g) ![]() CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
①ΔH_______0(填“>”、“<”或“=”)
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() =x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___________。
=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___________。

③右图中的B点对应的NH3的平衡转化率为___________。