题目内容
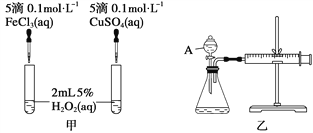
【题目】经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1)定性分析:
①如图甲可通过观察_____________________________________,定性比较得出结论。
②有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是__________________,
③若H2O2在二氧化锰催化作用下发生反应,曾检测出有物质MnO3出现,写出整个反应过程的两个化学方程式:___________________________,________________________。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是_________________。
【答案】 反应产生气泡的快慢 控制阴离子相同,排除阴离子的干扰 H2O2 +MnO2= MnO3+H2O 2MnO3= 2MnO2+O2↑ 分液漏斗 收集40 mL气体所需要的时间
【解析】(1)①催化剂的不同会引起反应速率的不同,所以根据反应中产生气泡的快慢来定性分析催化剂的催化效果,故答案是:反应产生气泡的快慢。
②为了是实验具有可比性,应该使溶液中的阴离子也相同,这样才能排出阴离子不同可能组成的干扰。故答案是:控制阴离子相同,排除阴离子的干扰
H2O2在二氧化锰催化作用下发生反应,检测出有物质MnO3出现,二氧化锰作为催化剂,MnO3为中间主物,MnO2先转化为MnO3然后又生成为MnO2。整个反应过程的两个化学方程式:H2O2 +MnO2= MnO3+H2O ; 2MnO3= 2MnO2+O2↑。
(2)从外观分析A是分液漏斗,收集相同的体积,因此需要测量所用时间的长短。故答案为:分液漏斗,收集40mL气体所需要的时间。

【题目】碳和氧元素及其化合物与人类的生产、生活密切相关。
I.氯的化合物合成、转化一直是科学研究的热点。
(1)一定条件下,氯气与氨气反应可以制备气态氯胺(NH2Cl),己知部分化学键的键能:
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/KJmol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
则上述反应的热化学方程式为:__________________。
(2)氯胺是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为_____________。
II.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。
(3)在三个容积均为1L的密闭容器中以不同的氢碳比![]() 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
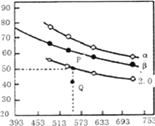
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(α、β、2.0分别代表三种氢碳比时的变化曲线)。
C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(α、β、2.0分别代表三种氢碳比时的变化曲线)。
请回答下列问题:
①反应的△H______0,氢碳比α____β,Q点v(正)_____v(逆)(填“>”或“<”、“=”)
②若起始时,CO2的浓度分别为0.5mol/L,則P点对应温度度的平衡常数的值为________。
(4)己知:碳酸 H2CO3: K1=4.3×10-7、K2=5.6×10-11;
草酸 H2C2O4: K1=6.0×10-2、K2=6.0×10-5
① 下列微粒可以大量共存的是_______(填字母)。
a.CO32-、HC2O4- b.H2CO3、C2O42- c. C2O42-、HCO3- d.H2C2O4、HCO3-
②若将等物质的量浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子(除OH-外)浓度由大到小的顺序是_________。