题目内容
【题目】下列物质的保存方法中,错误的是:
A. 氢氟酸要保存在塑料瓶中
B. 新制的氯水要保存在棕色细口瓶中,并放置在阴暗处
C. 少量液溴要保存在带有橡胶塞的棕色细口瓶中,并在液溴上面加水封
D. 单质碘要保存在棕色广口瓶中,并放置在阴凉处
【答案】C
【解析】A.氢氟酸与玻璃中的二氧化硅反应,则氢氟酸保存在塑料瓶中,选项A正确; B.氯水为液态,且HClO见光易分解,则氯水盛放在棕色的细口瓶中,并放置在阴暗处,选项B正确;C.液溴能腐蚀橡胶,不能用橡胶塞,应该使用玻璃塞,并用水封,选项C错误;D.实验室中,为了便于取用,固体药品应该保存在广口瓶中,且碘易升华,必须放置在阴凉处,选项D正确。答案选C。

【题目】.甲醇作为一种较好的可再生能源,具有广泛的应用前景。
已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g) ![]() CH3OH(g) H1=-90kJ·mol-1
CH3OH(g) H1=-90kJ·mol-1
②CO(g)+H2O(g) ![]() CO2(g) + H2(g) H2=-41kJ·mol-1
CO2(g) + H2(g) H2=-41kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:___________________。
Ⅱ. 已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡 常数 | 温度 | ||
500℃ | 700℃ | 800℃ | ||
2H2(g) + CO(g) | K1 | 2.5 | 0.34 | 0.15 |
H2(g) + CO2(g) | K2 | 1 | 1.7 | 2.52 |
3H2(g)+CO2(g) | K3 | |||
请回答下列问题:
(1)反应①是__________(填“吸热”或“放热“)反应
(2)观察①②③可推导出K1、K2、K3之间的关系,则K3=_______(用K1、K2表示)
(3)某温度时,反应①式中各物质的平衡浓度符合下式:20×c(CH2OH)=3×c(CO)×c3(H2),试判断此时的温度为____________。
(4)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分别为0.4 mol· L-1、1 mol·L-1、0.5 mol·L-1、0.4 mol·L-1molL-1,则此时V(正)______V(逆)(填“>”、 “=”或“<”)。
(5)对应反应③,一定条件下将H2(g)和CO2(g)以体积比3:1置于恒温恒容的密闭容器发生反应,下列能说明该反应达平衡状态的有_____________。
A.体系密度保持不变
B.H2和CO2的体积比保持不变
C.混合气体的平均相对分子量不变时,反应一定达到平衡状态
D.当破坏CO2中2个碳氧双键,同时破坏H2O中的2个氧氢键,反应一定达到平衡状态
【题目】碳和氧元素及其化合物与人类的生产、生活密切相关。
I.氯的化合物合成、转化一直是科学研究的热点。
(1)一定条件下,氯气与氨气反应可以制备气态氯胺(NH2Cl),己知部分化学键的键能:
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/KJmol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
则上述反应的热化学方程式为:__________________。
(2)氯胺是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为_____________。
II.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。
(3)在三个容积均为1L的密闭容器中以不同的氢碳比![]() 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(α、β、2.0分别代表三种氢碳比时的变化曲线)。
C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(α、β、2.0分别代表三种氢碳比时的变化曲线)。
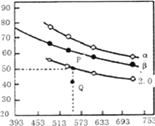
请回答下列问题:
①反应的△H______0,氢碳比α____β,Q点v(正)_____v(逆)(填“>”或“<”、“=”)
②若起始时,CO2的浓度分别为0.5mol/L,則P点对应温度度的平衡常数的值为________。
(4)己知:碳酸 H2CO3: K1=4.3×10-7、K2=5.6×10-11;
草酸 H2C2O4: K1=6.0×10-2、K2=6.0×10-5
① 下列微粒可以大量共存的是_______(填字母)。
a.CO32-、HC2O4- b.H2CO3、C2O42- c. C2O42-、HCO3- d.H2C2O4、HCO3-
②若将等物质的量浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子(除OH-外)浓度由大到小的顺序是_________。