题目内容
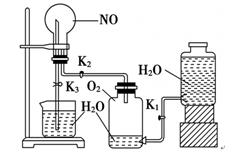
为验证铜与稀硝酸反应的还原产物是NO而不是NO2,设计了如下图的装置,以下叙述错误的是
| A.应先打开活塞再从右侧加稀硝酸 |
| B.左侧稀硝酸须注满 |
| C.关闭活塞后铜丝会全部溶解 |
| D.反应停止后打开活塞气体变成红棕色 |
C
解析试题分析:A、此做法是为了用稀硝酸排尽O2,防止NO被氧化,正确;B、排尽O2,使铜丝与稀硝酸接触反应,生成的NO不与O2接触,正确;C、稀硝酸浓度低到一定程度,铜丝不再溶解,错误;D、打开活塞,有O2与NO生成了红棕色的NO2,正确。
考点:考查铜丝与硝酸的反应及NO和NO2等相关知识。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
某实验过程如图所示,则图③试管中的现象是
| A.铜片溶解、产生无色气休,该气体遇空气变为红棕色 |
| B.铜片溶解.产生无色气体,该气体遇到空气不变色 |
| C.铜片溶解,放出红棕色有刺激性气味的气体 |
| D.无明显现象。因稀硫酸不与铜反应 |
下表实验中“操作及现象”与“给定溶液”的性质不对应的是
| 选项 | 溶液 | 操作及现象 |
| A | Ca(OH)2溶液 | 通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。再加入足量NaOH溶液,又变浑浊。 |
| B | 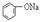 溶液 溶液 | 通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。 |
| C | Ca(ClO)2溶液 | 通入CO2,溶液没有明显变化。再滴入品红溶液,红色褪去。 |
| D | CaCl2溶液 | 通入CO2,溶液没有明显变化。若同时通入CO2和NH3,则溶液变浑浊。 |
加入少许下列一种物质,不能使溴水颜色变浅的是
| A.Mg粉 | B.H2S(g) | C.KI(s) | D.CCl4 |
亚硝酸钠是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质或用途见图。下列说法不正确的是( )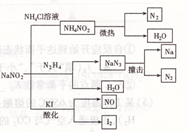
| A.NaNO2的稳定性大于NH4NO2 |
| B.NaNO2与N2 H4反应,NaNO2是氧化剂 |
| C.可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2 |
| D.NaN3分解,每产生1molN2转移6mole- |
CO2、NO2、SO2是中学常见的氧化物,下列有关三种氧化物的叙述正确的是( )
| A.它们均可与水反应生成酸,所以都是酸性氧化物 |
| B.它们都是无色、密度比空气大的有毒气体 |
| C.人类活动中过度排放CO2、SO2和NO2,都会引起酸雨 |
| D.它们在反应中都可做氧化剂 |
下列有关硅及其化合物的说法正确的是
| A.单质硅常用作半导体和光导纤维材料 |
| B.硅在自然界中只以化合态的形式存在 |
| C.SiO2与纯碱高温生成CO2,说明硅酸的酸性比碳酸强 |
| D.SiO2是非金属氧化物,它不与任何酸反应 |
研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示) 。
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:
负极 ,正极 。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。(填序号)
| A.体系压强保持不变 | B.混合气体颜色保持不变 |
| C.SO3、NO的体积比保持不变 | D.每消耗 1 mol SO2,同时生成1 mol NO |
(4)工业常用Na2CO3饱和溶液回收NO、NO2气体:
NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2
若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为 。