题目内容
下表实验中“操作及现象”与“给定溶液”的性质不对应的是
| 选项 | 溶液 | 操作及现象 |
| A | Ca(OH)2溶液 | 通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。再加入足量NaOH溶液,又变浑浊。 |
| B | 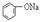 溶液 溶液 | 通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。 |
| C | Ca(ClO)2溶液 | 通入CO2,溶液没有明显变化。再滴入品红溶液,红色褪去。 |
| D | CaCl2溶液 | 通入CO2,溶液没有明显变化。若同时通入CO2和NH3,则溶液变浑浊。 |
B
解析试题分析:A.NaAlO2溶液与CO2反应生成沉淀Al(OH)3,Al(OH)3不溶于弱酸,则浊液不变澄清,故A正确;B.Na2SiO3溶液与CO2反应生成硅酸沉淀,继续通CO2至过量,浑浊不消失,故B错误;C.Ca(ClO)2溶液与CO2反应生成HClO,HClO具有漂白性,可使品红溶液褪色,故C正确;D.Ca(OH)2溶液通人CO2,生成碳酸钙沉淀,继续通CO2至过量生成碳酸氢钙,碳酸氢钙与NaOH反应又生成碳酸钙沉淀,故D正确.故选B.
考点:本题考查化学实验方案的评价,题目难度不大,注意把握相关物质的性质,为解答该题的关键.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
| A.在空气中敞口久置的浓硫酸,溶液质量增大(脱水性) |
| B.在加热条件下铜与浓硫酸反应(氧化性、酸性) |
| C.蔗糖与浓硫酸反应中有海棉状的炭生成(吸水性) |
| D.浓硫酸可用来干燥某些气体(不挥发性) |
下列有关氯气的叙述,不正确的是( )
| A.氯气是一种黄绿色气体 |
| B.氯气、液氯、氯水是同一种物质 |
| C.氯气能溶于水 |
| D.氯气是一种有毒气体 |
如图所示装置,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶中,然后打开止水夹,不能出现“喷泉现象”,则物质a、b对应的选项是
| 选项 | a(干燥气体) | b(液体) |
| A | NO | H2O |
| B | Cl2 | 饱和NaCl溶液 |
| C | SO2 | 浓NaOH溶液 |
| D | NH3 | H2O |
科学家发现微量硫化氢可以调节心血管功能。有关硫化氢的叙述正确的是
| A.硫化氢很稳定,受热难分解 |
| B.将硫化氢通入氯水中,氯水褪色并产生浑浊 |
| C.硫化氢在足量氧气中燃烧生成淡黄色固体 |
| D.硫化氢是弱电解质,其电离方程式是H2S ? 2H+ + S2- |
Na2O2、Cl2和SO2均能使品红溶液褪色(NA为阿伏加德罗常数的值)。下列说法正确的是
| A.Na2O2、Cl2、SO2使品红溶液褪色的原理相同 |
| B.标准状况下,1 mol Na2O2和22.4LCO2反应,转移电子数目为NA |
| C.等物质的量的Cl2和SO2同时通入品红溶液中,品红褪色更快 |
| D.在Na2O2中阴阳离子所含的电子数目相等 |
为验证铜与稀硝酸反应的还原产物是NO而不是NO2,设计了如下图的装置,以下叙述错误的是
| A.应先打开活塞再从右侧加稀硝酸 |
| B.左侧稀硝酸须注满 |
| C.关闭活塞后铜丝会全部溶解 |
| D.反应停止后打开活塞气体变成红棕色 |