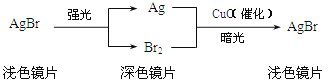
题目内容
【题目】某同学设计如下实验方案,用以分离 KCl和BaCl2两种混合物,供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。
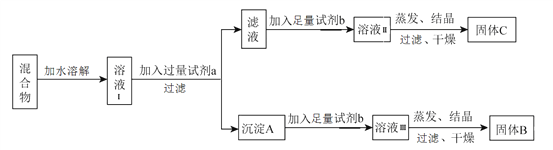
下列说法中,正确的是
A. 试剂 a是K2SO4 溶液
B. 试剂 b是盐酸
C. 固体 C是BaCl2
D. 不加试剂 b,将滤液直接蒸发、结晶,过滤后干燥也能得到纯净的固体C
【答案】B
【解析】分离KCl和BaCl2两种固体混合物,可先溶于水得到溶液Ⅰ,然后加入过量试剂a为K2CO3使BaCl2转化为沉淀A,过滤后沉淀加入足量试剂b为盐酸,盐酸可生成溶液ⅢBaCl2溶液,经蒸发、结晶、干燥后可得固体B为BaCl2,所得滤液为KCl和K2CO3的混合物,加入足量试剂b为盐酸,盐酸与碳酸钾反应生成氯化钾,蒸发结晶得到固体C为KCl。故A. 试剂 a是K2CO3 溶液,选项A错误;B. 试剂 b是盐酸,选项B正确;C. 固体 C是KCl,选项C错误;D. 不加试剂 b,滤液中含有KCl和K2CO3,将滤液直接蒸发、结晶,过滤后干燥得到固体C为KCl和K2CO3的混合物,选项D错误。 答案选B。

【题目】(酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.
实验 | 消耗0.1000molL﹣1的 | 待测氢氧化钠 |
1 | 29.02 | 25.00 |
2 | 28.01 | 25.00 |
3 | 27.99 | 25.00 |
(1)如图所示A的pH范围使用的指示剂是;
(2)用0.1000molL﹣1的盐酸溶液滴定未知浓度的氢氧化钠溶液,重复三次的实验数据如表所示.则待测氢氧化钠的物质的量浓度是molL﹣1 . 在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测定结果将(填“偏高”、“偏低”或“不影响”).
(3)下列关于上述中和滴定过程中的操作正确的是(填序号)
A.用碱式滴定管量取未知浓度的烧碱溶液
B.滴定管和锥形瓶都必须用待盛放液润洗
C.滴定中始终注视锥形瓶中溶液颜色变化
D.锥形瓶中的待测液可用量筒量取.