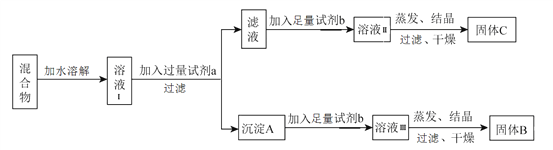
��Ŀ����
����Ŀ��A��B��C��DΪԭ������������������ֶ�����Ԫ�أ�A2����B+������ͬ�ĵ��ӹ��ͣ�C��DΪͬ����Ԫ�أ�C�������������������������3����DԪ���������һ��δ�ɶԵ��ӣ� �ش��������⣺
��1��Cԭ�ӵĺ�������Ų�ʽΪ ��
��2������A������ͬ�������壬���зе�ߵ����������ʽ����ԭ������A��B��D��Ԫ����ɵĻ����������ľ��������� ��
��3��C��D��Ӧ��������ɱ�Ϊ1��3�Ļ�����E��E�����幹��Ϊ �� ����ԭ�ӵ��ӻ��������Ϊ ��
��4��A��B�ܹ��γɻ�����1��1�Ļ����д���˻�����ĵ���ʽ ��
���𰸡�
��1��1s22s22p63s22p3
��2��O3��O3���ԭ�������ϴ��»����ϴ����Ӽ������ۼ�
��3��������sp3
��4��![]()
���������⣺C�������������������������3����ӦΪPԪ�أ�C��DΪͬ����Ԫ�أ���ӦΪ��������Ԫ�أ�DԪ���������һ��δ�ɶԵ��ӣ�ӦΪClԪ�أ�A2����B+������ͬ�ĵ��ӹ��ͣ����ԭ��������ϵ��֪AΪOԪ�أ�BΪNaԪ�أ���1��CΪ��Ԫ�أ�ԭ�Ӻ��������Ϊ15����������Ų�ʽΪ��1s22s22p63s22p3 �� ���Դ��ǣ�1s22s22p63s22p3����2��AΪOԪ�أ���O2��O3����ͬ�������壬���߶�Ӧ�ľ��嶼Ϊ���Ӿ��壬��O3���ԭ�������ϴ��»����ϴе�ϸߣ�A��B��D��Ԫ����ɵĻ�����ΪNaClO�ȣ��������Ӽ������ۼ���
���Դ��ǣ�O3��O3���ԭ�������ϴ��»����ϴ����Ӽ������ۼ�����3��C��D��Ӧ������1��3�Ļ�����EΪPCl3 �� ������Pԭ���γ�3��P��Cl����������1�Թ¶Ե��ӣ����ӿռ�ṹΪ�����Σ�Pԭ�Ӳ�ȡsp3�ӻ���
���Դ��ǣ������Σ�sp3����4��A��B�ܹ��γɻ�����1��1�Ļ�����Na2O2 �� ������������������ӹ��ɣ�����ʽΪ ![]() ��
��
���Դ��ǣ� ![]() ��
��

����Ŀ���������ʵķ�����ȷ���ǣ� ��
���� | ���������� | ���������� | �� | �� | �� | |
A | H2 | �ɱ� | CuO | H2SO4 | ���� | ��ʯ�� |
B | ��� | SO2 | Na2O | HCl | NH3��H2O | NaCl |
C | Һ�� | CO | Fe2O3 | CH3COOH | CH3CH2OH | �̷� |
D | HD | P2O5 | ��ʯ�� | HNO3 | KOH | CaCO3 |
A. A B. B C. C D. D