题目内容
【题目】由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:
[铜矿石] ![]() [铜精矿石]
[铜精矿石] ![]() [冰铜]
[冰铜] ![]() [粗铜]
[粗铜] ![]() [电解铜]
[电解铜]
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物.
①该过程中两个主要反应的化学方程式分别是、;
②反射炉内生成炉渣的主要成分是 .
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%.转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼.冰铜中的Cu2S被氧化为Cu2O.生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜.该过程发生反应的化学方程式分别是、 .
(3)粗铜的电解精炼如图所示.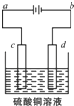
①在粗铜的电解过程中,粗铜板应是图中电极(填图中的字母);
②在电极d上发生的电极反应式为;
③若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 .
【答案】
(1)2CuFeS2+O2 ![]() Cu2S+2FeS+SO2,FeS+3O2
Cu2S+2FeS+SO2,FeS+3O2 ![]() 2FeO+2SO2,FeSiO3
2FeO+2SO2,FeSiO3
(2)2Cu2S+3O2 ![]() 2Cu2O+2SO2,2Cu2O+Cu2S
2Cu2O+2SO2,2Cu2O+Cu2S ![]() 6Cu+2SO2↑
6Cu+2SO2↑
(3)c,Cu2++2e﹣=Cu,Au、Ag以单质形式沉积在c(阳极)下方,Fe以Fe2+的形式进入电解液中
【解析】解:(1)①黄铜矿与空气反应生成Cu2S、FeS,根据化合价升降相等配平,反应方程式为:2CuFeS2+O2 ![]() Cu2S+2FeS+SO2;FeS和氧气反应生成FeO,根据化合价升降相等,配平方程式为:FeS+3O2
Cu2S+2FeS+SO2;FeS和氧气反应生成FeO,根据化合价升降相等,配平方程式为:FeS+3O2 ![]() 2FeO+2SO2;
2FeO+2SO2;
故答案是:2CuFeS2+O2 ![]() Cu2S+2FeS+SO2;FeS+3O2
Cu2S+2FeS+SO2;FeS+3O2 ![]() 2FeO+2SO2;②二氧化硅在高温下与FeO反应生成FeSiO3,所以生成炉渣的主要成分为:FeSiO3,所以答案是:FeSiO3;(2)Cu2S被氧气氧化生成二氧化硫和Cu2O:2Cu2S+3O2
2FeO+2SO2;②二氧化硅在高温下与FeO反应生成FeSiO3,所以生成炉渣的主要成分为:FeSiO3,所以答案是:FeSiO3;(2)Cu2S被氧气氧化生成二氧化硫和Cu2O:2Cu2S+3O2 ![]() 2Cu2O+2SO2;Cu2O与Cu2S反应:2Cu2O+Cu2S
2Cu2O+2SO2;Cu2O与Cu2S反应:2Cu2O+Cu2S ![]() 6Cu+2SO2↑,
6Cu+2SO2↑,
故答案是:2Cu2S+3O2 ![]() 2Cu2O+2SO2;2Cu2O+Cu2S
2Cu2O+2SO2;2Cu2O+Cu2S ![]() 6Cu+2SO2↑;(3①c连电源正极,d连电源的负极;故c为阳极,d为阴极;粗铜板应放在阳极,即c;所以答案是:c;②d阴极发生还原反应,阴极上铜离子得电子生成Cu,则方程式为:Cu2++2e﹣=Cu;所以答案是:Cu2++2e﹣=Cu;③Au、Ag比较稳定,不反应,以单质形式沉积在c(阳极)下方,Fe失去电子变成Fe2+的形式进入电解液中,
6Cu+2SO2↑;(3①c连电源正极,d连电源的负极;故c为阳极,d为阴极;粗铜板应放在阳极,即c;所以答案是:c;②d阴极发生还原反应,阴极上铜离子得电子生成Cu,则方程式为:Cu2++2e﹣=Cu;所以答案是:Cu2++2e﹣=Cu;③Au、Ag比较稳定,不反应,以单质形式沉积在c(阳极)下方,Fe失去电子变成Fe2+的形式进入电解液中,
所以答案是:Au、Ag以单质形式沉积在c(阳极)下方,Fe以Fe2+的形式进入电解液中.

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案