题目内容
【题目】标出下列氧化还原反应的电子转移数目和方向,并写出氧化剂
(1)5MnSO4 + 2NaClO3 + 4H2O ![]() 5MnO2 + Na2SO4 + Cl2 ↑+ 4H2SO4 ___________,氧化剂是______
5MnO2 + Na2SO4 + Cl2 ↑+ 4H2SO4 ___________,氧化剂是______
(2)2FeCl3 + 10NaOH + 3NaClO ![]() 2Na2FeO4 + 9NaCl + 5H2O_____________,氧化剂是_____
2Na2FeO4 + 9NaCl + 5H2O_____________,氧化剂是_____
【答案】  NaClO3
NaClO3 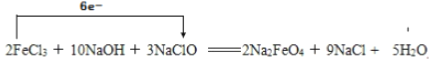 NaClO
NaClO
【解析】(1)5MnSO4 + 2NaClO3 + 4H2O ![]() 5MnO2 + Na2SO4 + Cl2 ↑+ 4H2SO4,反应中锰元素化合价升高失电子,MnSO4是还原剂;氯元素化合价降低得电子,NaClO3是氧化剂,电子转移数目和方向表示如下:
5MnO2 + Na2SO4 + Cl2 ↑+ 4H2SO4,反应中锰元素化合价升高失电子,MnSO4是还原剂;氯元素化合价降低得电子,NaClO3是氧化剂,电子转移数目和方向表示如下: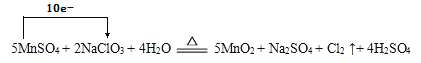 ;(2)2FeCl3 + 10NaOH + 3NaClO
;(2)2FeCl3 + 10NaOH + 3NaClO ![]() 2Na2FeO4 + 9NaCl + 5H2O反应中铁元素化合价升高失电子,FeCl3是还原剂;氯元素化合价降低得电子,NaClO是氧化剂,电子转移数目和方向表示如下:
2Na2FeO4 + 9NaCl + 5H2O反应中铁元素化合价升高失电子,FeCl3是还原剂;氯元素化合价降低得电子,NaClO是氧化剂,电子转移数目和方向表示如下: 。
。

练习册系列答案
相关题目
【题目】下列物质的分类正确的是( )
单质 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 | |
A | H2 | 干冰 | CuO | H2SO4 | 纯碱 | 熟石灰 |
B | 碘酒 | SO2 | Na2O | HCl | NH3·H2O | NaCl |
C | 液氯 | CO | Fe2O3 | CH3COOH | CH3CH2OH | 绿矾 |
D | HD | P2O5 | 生石灰 | HNO3 | KOH | CaCO3 |
A. A B. B C. C D. D