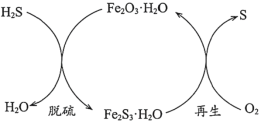
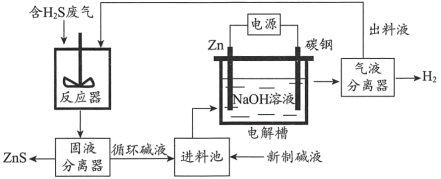
题目内容
【题目】在C(s)+CO2(g)![]() 2CO(g)反应中,可使反应速率增大的措施是
2CO(g)反应中,可使反应速率增大的措施是
①压缩容器体积 ②增加炭的量 ③恒容下通入CO2 ④恒压下充入N2 ⑤恒容下充入N2 ⑥升高温度
A.①③⑥B.②④⑥C.①③④D.③⑤⑥
【答案】A
【解析】
增大反应的化学反应速率,可通过增大浓度、升高温度、使用催化剂等措施,对于气体参加的反应,还可以增大压强。
①缩小容器体积,压强增大,反应速率加快,故①正确;
②C是固体,增加C的量,不影响反应速率,故②错误;
③恒容下通入CO2,CO2浓度增大,反应速率加快,故③正确;
④恒压下充入N2,体积增大,参加反应的气体的浓度减小,反应速率减小,故④错误;
⑤恒容下充入N2,参加反应的气体的浓度不变,反应速率不变,故⑤错误;
⑥恒容下通入CO,气体浓度增大,反应速率增大,故⑥正确。
故选A。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 2×10﹣5 |
HClO | HClO | 3.0×10﹣8 |
H2CO3 | H2CO3 HCO3﹣ | K1=4.4×10﹣7 K2=5.61×10﹣11 |
H3PO4 | H3PO4 H2PO4﹣ HPO42﹣ | K1=7.1×10﹣3 K2=6.3×10﹣8 K3=4.2×10﹣13 |
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3﹣、H3PO4、H2PO4﹣、HPO42﹣都看作是酸,则它们酸性最强的是_______(填化学式,下同),最弱的是________。
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为_______。
(3)求出该温度下,0.10molL﹣
(4)该温度下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是____。
A.c(H+) B.c(H+)c(CH3COO﹣) C.c(H+)c(OH﹣) D.c(OH﹣)/c(H+)
(5)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1_____V2( 填“>”、“<”或“=”)。
(6)下列四种离子结合H+能力最强的是_______。
A.HCO3﹣ B.CO32﹣ C.ClO﹣ D.CH3COO﹣
(7)等物质的量的苛性钠分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是(_________)
A.Va>10Vb B.Va<10Vb C.Vb <10 Va D.Vb>10Va