题目内容
【题目】反应N2(g)+O2(g)=2NO(g)的能量变化如图所示。
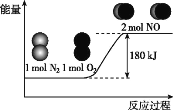
已知:断开1molN2(g)中化学键需吸收946kJ能量,断开1molO2(g)中化学键需吸收498kJ能量。下列说法正确的是( )
A.N2和O2的总能量一定高于NO的总能量
B.2NO(g)=N2(g)+O2(g),该反应为吸热反应
C.断开1molNO(g)中化学键需吸收90kJ能量
D.形成1molNO(g)中化学键可释放632kJ能量
【答案】D
【解析】
由图中可以提取如下信息:(1)反应物的总能量低于生成物的总能量;(2)反应的热化学方程式为:N2(g)+O2(g)=2NO(g) H=+180kJ/mol。
A.从图中可以看出,N2和O2的总能量低于NO的总能量,A不正确;
B.N2(g)+O2(g)=2NO(g)为吸热反应,则2NO(g)=N2(g)+O2(g)为放热反应,B不正确;
C.断开1molNO(g)中化学键需吸收的能量为![]() kJ=632kJ,C不正确;
kJ=632kJ,C不正确;
D.由C选项的计算可知,形成1molNO(g)中化学键,可释放的能量为632kJ ,D正确;
故选D。

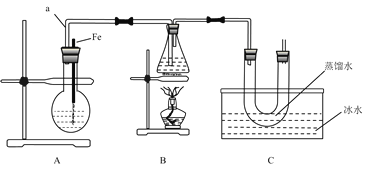
【题目】某研究性学习小组的同学设计了如图装置制取溴苯和溴乙烷:
己知:乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
溶解性(本身均可作溶剂) | 沸点(℃) | 密度(g/mL) | |
乙醇 | 与水互溶,易溶于有机溶剂 | 78.5 | 0.8 |
溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
请回答下列问题:
(1) B中发生反应生成目标产物的化学方程式为_________。
(2)根据实验目的,选择下列合适的实验步骤:①→___________(选填②③④等)。
①组装好装置,___________(填写实验操作名称);
②将A装置中的纯铁丝小心向下插入苯和液溴的混合液中;
③点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10分钟;
④向烧瓶中加入一定量苯和液溴,向锥形瓶中加入无水乙醇至稍高于进气导管口处,向U形管中加入蒸馏水封住管底,向水槽中加入冰水。
(3)简述实验中用纯铁丝代替铁粉的优点:_____。
(4)冰水的作用是_______。
(5)反应完毕后,U形管内的现象是______________;分离溴乙烷时所需的玻璃仪器有_____。

