题目内容
【题目】现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量。量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片。请回答下列问题:
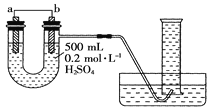
(1)b电极反应式为___。
(2)当量筒中收集到672mL(标准状况下)气体时,通过导线的电子的物质的量为__,此时a电极质量减少____g。
(3)如果将a、b两电极的电极材料对调,U形管中将出现的现象是___。
【答案】2H++2e-=H2↑ 0.06mol 1.95 左端液面下降,右端液面上升
【解析】
纯铜片和纯锌片、稀硫酸组成原电池,由图可知b电极处有氢气生成,则b为铜,为正极;a为锌,为负极。
(1)根据分析b为正极,b上氢离子得电子生成氢气,其电极反应式为:2H++2e═H2↑;
(2)当量筒中收集到672mL(标准状况下)气体,则n(H2)=![]() ,,已知b上的电极反应式为:2H++2e═H2↑,则通过导线的电子的物质的量为0.06mol,a电极上的反应为:Zn2e═Zn2+,则溶解的Zn的物质的量为0.03mol,则减小的Zn的质量为65g/mol×0.03mol=1.95g;
,,已知b上的电极反应式为:2H++2e═H2↑,则通过导线的电子的物质的量为0.06mol,a电极上的反应为:Zn2e═Zn2+,则溶解的Zn的物质的量为0.03mol,则减小的Zn的质量为65g/mol×0.03mol=1.95g;
(3)如果将a、b两电极的电极材料对调,则右边为锌失电子作负极,左边为铜为正极,氢离子得电子生成氢气,则左边上有氢气生成,所以U形管中出现的现象是左端液面下降,右端液面上升。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目