题目内容
【题目】如图所示是原电池的装置图。请回答:
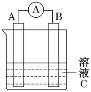
(1)若C为稀H2SO4,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为___;反应进行一段时间后溶液酸性将__(填“增强”“减弱”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为___,B(负极)极材料为__,溶液C为___。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:

电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是__(填“正极”或“负极”),c电极的反应方程式为__。若线路中转移1mol电子,则上述CH3OH燃料电池消耗的O2在标准状况下的体积为__L。
【答案】2H++2e-=H2↑ 减弱 石墨 Cu FeCl3溶液 正极 CH3OH-6e-+H2O=CO2+6H+ 5.6
【解析】
根据原电池原理进行判断,负极发生失电子的氧化反应,正极发生得电子的还原反应。根据氧化还原反应,化合价升高的一极作负极,失电子,发生氧化反应;化合价降低的一极作正极,得电子,发生还原反应。燃料电池中,正极通入的是氧气,负极充入的是CH3OH,根据化合价的变化写出电极反应式。
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B极电极材料为Fe且作负极,A电极为正极,电极材料为较铁不活泼的金属或非金属,发生还原反应,溶液中的氢离子得电子生成氢气,电极反应方程式为:2H++2e-=H2↑;由原电池的总反应可知,反应一段时间后,溶液C的pH升高,酸性减弱;
(2)分析反应Cu+2Fe3+=Cu2++2Fe2+,将其拆分为两个半反应,分别为:Cu-2e-=Cu2+,2Fe3++2e-=2Fe2+,根据原电池原理,可知负极电极反应式为:Cu-2e-=Cu2+,正极的电极反应式为:2Fe3++2e-=2Fe2+,正负极材料分别为:负极为Cu,正极为石墨(或Pt),含Fe3+的溶液(如FeCl3溶液)作电解质溶液,用导线连接正、负极,构成闭合回路即可构成原电池;
(3)根据燃料电池结构示意图中电子流向可知,c电极为负极,发生氧化反应,其电极反应方程式为:CH3OH-6e-+H2O=CO2+6H+,电极d为正极,O2得到电子,发生还原反应,电极反应方程式为:4H++4e-+O2=2H2O;1mol氧气在反应中得到4mol电子,若线路中转移1mol电子,则消耗氧气0.25mol,标准状况下的体积为V=nVm =0.25mol×22.4L/mol=5.6L。

 名校课堂系列答案
名校课堂系列答案