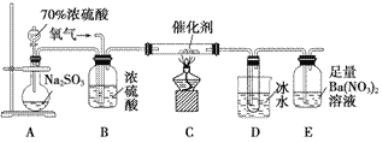
题目内容
【题目】直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如右图。下列关于它的说法正确的是
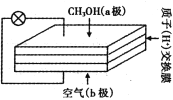
A. 电子自b极经外电路流向a极
B. b极的电极反应式为O2 +4e - +4H+= 2H2O
C. 质子交换膜中的H+流向a极
D. 用该电池电解CuSO4溶液,理论上每生成0.1 molCu消耗氧气1.12 L
【答案】B
【解析】交换膜为质子交换膜,所以电解质溶液呈酸性,燃料电池中负极上加入燃料、正极上通入氧化剂,所以该燃料电池中,a为负极、b为正极,负极反应式为CH3OH(l)+H2O(l)-6e-=CO2(g)↑+6H+、正极反应式为O2+4e-+4H+=2H2O。A.燃料电池中加入燃料电极是负极、加入氧化剂电极是正极,所以加入甲醇的电极a是负极、加入空气的电极b是正极,电子从 a沿导线流向b电极,故A错误;B.b是正极,电解质溶液呈酸性,正极反应式为O2+4e-+4H+=2H2O,故B正确;C.放电时,阳离子向正极移动,a是负极、b是正极,所以质子交换膜中的H+流向b极,故C错误;D.温度和压强未知,无法确定气体摩尔体积,所以不能计算需要氧气体积,故D错误;故选B。

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目