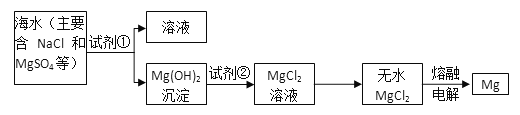
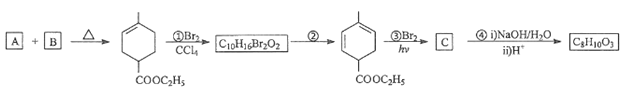
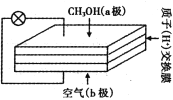
题目内容
【题目】将铜加入一定量稀硫酸和过氧化氢混合溶液中,充分反应后,溶液呈蓝色,有无色气体产生;若还发现容器底部有少量固体,则该固体可能是( )
A.Cu
B.S
C.CuS
D.Cu2S
【答案】A
【解析】解:Cu与硫酸、过氧化氢反应生成硫酸铜和水,Cu+H2O2+2H+═Cu2++2H2O,过氧化氢分解生成氧气,2H2O2=2H2↑+O2↑,稀硫酸没有强氧化性,则反应中S元素没变价,所以不能生成S、CuS、Cu2S,Cu可能过量,所以容器底部有少量固体为Cu;故选A.
Cu与硫酸、过氧化氢反应生成硫酸铜和水,Cu+H2O2+2H+═Cu2++2H2O,过氧化氢分解生成氧气,2H2O2=2H2↑+O2↑,根据反应分析.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】从镍矿石尾矿中提取NiSO4是解决我国镍资源匮乏的一条重要途径,已知该过程如下:
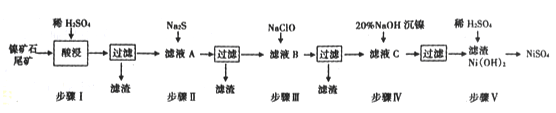
表1:各物质的Ksp数据如下表:
物质 | MnS | NiS | PbS | CuS | Ni(OH)2 |
Ksp | 2.5×10-13 | 1.1×10-21 | 8.0×10-28 | 6.3×10-36 | 2.0×10-15 |
表2:滤液A中各金属离子的含量如下表:
成分 | Ni2+ | Fe3+ | Fe2+ | Mn2+ | Cu2+ | Pb2+ | …… |
3.80 | 4.80 | x | 0. 20 | 0.15 | <0.001 | …… |
根据以上信息,回答下列问题:
(1)步骤I酸浸之前需将矿石粉碎,目的是____________。
(2)若杂质离子的浓度c≤1.0×10-5mol/L即可认定沉淀完全,则步骤Ⅱ中当Pb2+“恰好沉淀完全时,溶液中硫离子的浓度c(S2-)=_____________
(3)常温下进行步骤Ⅲ的目的是为了除去铁和锰元素,已知除铁元素的离子反应如下:
2Fe2++ ClO - +5H2O=2Fe( OH)3↓+Cl-+4H+
此时Mn2+的氧化产物为MnO2,写出除锰元素的离子方程式______________。
(4)为测定滤液A中Fe2+离子的含量,(每升溶液中含有的亚铁离子的质量,以g/L表示)每次移取20.00 mL待测液,并用0.02 mol/L的KMnO4溶液滴定,若已知其他离子均不反应,且三次滴定平均消耗KMnO4溶液18. 00mL,则x的值为________(精确到小数点后两位)。
(5)所得Ni(OH)2是制造镍镉电池的重要原料,镍镉电池工作原理如下:
Cd+2NiO(OH) +2H2O![]() Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
则随着放电的进行,正极区pH______(填“增大”、“减小”或“不变”);充电时阴极电极反应式为______。