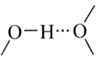题目内容
【题目】东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的价电子轨道表示式___,3d能级上的未成对的电子数为___。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为___,提供孤电子对的成键原子是___。
③氨的沸点_______(“高于”或“低于”)膦(PH3),原因是______。
(3)单质铜及镍都是由__键形成的晶体:元素同与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是___。
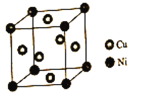
(4)某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为___。
②若合金的密度为dg/cm3,晶胞参数a=____nm。
【答案】![]() 2 正四面体 配位键 N 高于 NH3分子间可以形成氢键,熔沸点升高 金属键 铜的3d能级是全满状态,更稳定 3:1
2 正四面体 配位键 N 高于 NH3分子间可以形成氢键,熔沸点升高 金属键 铜的3d能级是全满状态,更稳定 3:1  ×107
×107
【解析】
(1)Ni元素原子核外电子数为28,结合能量最低原理书写核外电子排布式;
(2)①SO42-中S原子的成键电子对数=4,孤电子对数=![]() =0,价层电子对数=4+0=4;
=0,价层电子对数=4+0=4;
②Ni2+提供空轨道,NH3中N原子含有孤电子对,二者之间形成配位键;
③PH3分子之间为范德华力,氨气分子之间形成氢键,增大了物质的沸点;
(3)单质铜及镍都属于金属晶体;Cu+的外围电子排布为3d10,Ni+的外围电子排布为3d84s1,Cu+的核外电子排布更稳定;
(4)①根据均摊法计算晶胞中Ni、Cu原子数目;
②根据m=ρV计算晶胞参数。
(1)Ni元素原子核外电子数为28,核外电子排布式为1s22s22p63s23p63d84s2,其价层电子轨道式为![]() ,3d能级上的未成对电子数为2;
,3d能级上的未成对电子数为2;
(2)①SO42-中S原子的成键电子对数=4,孤电子对数=![]() =0,价层电子对数=4+0=4,离子空间构型为正四面体;
=0,价层电子对数=4+0=4,离子空间构型为正四面体;
②Ni2+提供空轨道,NH3中N原子含有孤电子对,提供孤电子对,二者之间形成配位键;
③PH3分子之间为范德华力,氨气分子之间形成氢键,分子之间的作用力更强,增大了物质的沸点,故氨气的沸点高于PH3分子的;
(3)单质铜及镍都属于金属晶体,都是由金属键形成的晶体;Cu+的外围电子排布为3d104s1,Ni+的外围电子排布为3d84s2,Cu+的核外电子排布3d轨道处于全充满的稳定状态,再失去第二个电子更难,而镍失去的是4s轨道的电子,所以元素铜的第二电离能高于镍。
(4)①晶胞中Ni处于顶点,Cu处于面心,则晶胞中Ni原子数目为8×![]() =1,Cu原子数目=6×
=1,Cu原子数目=6×![]() =3,故Cu与Ni原子数目之比为3:1。
=3,故Cu与Ni原子数目之比为3:1。
②该晶胞属于面心立方密堆积,晶胞质量质量为![]() g,根据m=ρV可有:
g,根据m=ρV可有:![]() g=dgcm-3×(a×10-7cm)3,解得a=
g=dgcm-3×(a×10-7cm)3,解得a= ×107。
×107。