题目内容
【题目】已知烯烃经臭氧氧化后,在Zn存在下水解,可得到醛和一种有机物酮,如:
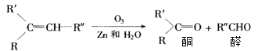
现有化学式C7H14的烯烃,与H2完全加成后的产物,核磁共振氢谱有三组峰,且峰面积之比为9:6:1,满足条件的烯烃经O3氧化后,在Zn存在下水解的产物共可能有几种(不考虑立体异构)( )
A. 2种B. 4种C. 5种D. 6种
【答案】C
【解析】
化学式C7H14的烯烃,与H2完全加成后的产物,核磁共振氢谱有三组峰,峰面积之比为9:6:1,则生成的烷烃可为CH(CH2CH3)3、C(CH3)3CH(CH3)2,对应的烯烃可为CH2=CHCH(CH2CH3)2或CH3CH=C(CH2CH3)2,和C(CH3)3C(CH3)=CH2,经臭氧氧化后,在Zn存在下水解的产物有5种。
故答案选C。

 手拉手全优练考卷系列答案
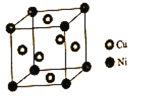
手拉手全优练考卷系列答案【题目】现有六种元素,其中A、B、C、D、E为短周期主要族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
B元素原子的核外p电子数比s电子数少1 |
C元素基态原子p轨道有两个未成对电子 |
D原子的第一至第四电离能分别是: Ⅰ1=738kJ·mol-1;Ⅰ2=1451kJ·mol-1;Ⅰ3=7733kJ·mol-1;Ⅰ4=10540kJ·mol-1; |
E原子核外所有p轨道全满或半满 |
F在周期表的第8纵列 |
(1)某同学根据上述信息,推断A基态原子的核外最子排布为了![]() ,该同学所画的电子排布图违背了___________。
,该同学所画的电子排布图违背了___________。
(2)B元素的电负性_____(填“大于”、“小于”或“等于”)C元素的电负性。
(3)C与D形成的化合物所含有的化学键类型为_____________。
(4)E基态原子中能量最高的电子,其电子云在空间有__________个方向。
(5)下列关于F原子的价层电子排布图正确的是___________。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(6)基态F3+离子核外电子排布式为_____________。过量单质F与B的最高价氧化物的水化物的稀溶液完全反应,生成BC气体,该反应的离子方程式为____________。
(7)元素铜与镍的第二电离能分别为:ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi原因是__________________。
【题目】某中学化学兴趣小组为了调查当地某一湖泊的水质污染情况,在注入湖泊的3个主要水源的入口处采集水样,并进行了分析,给出了如下实验信息:其中一处水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E为五种常见化合物,均由下表中的离子形成:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO42- HCO3- NO3- OH- |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀:
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出C、D、的化学式:C_______,D______。
(2)将含1 mol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,请写出A与E反应的离子方程式:_______________。
(3)在A溶液中加入少量澄清石灰水,其离子方程式为_____________________。
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理______________________。
(5)若向含溶质0.5 mol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为__________g。