题目内容
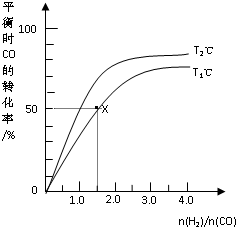 在2L的密闭容器中,起始时均投入2mol CO,在不同条件下发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.有关信息如图所示,下列说法正确的是( )
在2L的密闭容器中,起始时均投入2mol CO,在不同条件下发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.有关信息如图所示,下列说法正确的是( )| A、T1<T2 | ||
| B、T1℃时该反应的平衡常数为4.0 L2?mol-2 | ||
C、同一温度下,
| ||
D、相同条件下
|
考点:转化率随温度、压强的变化曲线
专题:化学平衡专题
分析:A.根据“先拐先平数值大”确定温度高低;
B.根据K=
计算平衡常数;
C.平衡常数只与温度有关;
D.根据图象中纵横坐标变化趋势分析.
B.根据K=
| c(CH3OH) |
| c(CO).c2(H2) |
C.平衡常数只与温度有关;
D.根据图象中纵横坐标变化趋势分析.
解答:
解:A.根据“先拐先平数值大”知,T1℃先达到平衡状态,所以T1>T2,故A错误;
B.X点,n(H2)/n(CO)=1.5,起始时均投入2mol CO,则投入氢气的3mol,CO的转化率为50%,则平衡时c(CO)=
=0.5mol/L,C(H2)=
=0.5mol/L,c(CH3OH)=
=0.5mol/L,K=
=
=4,温度不变,平衡常数不变,所以T1℃时该反应的平衡常数为4.0 L2?mol-2,故B正确;
C.平衡常数只与温度有关,温度不变,平衡常数不变,与物质浓度无关,故C错误;
D.根据图象中纵横坐标变化趋势知,相同条件下
越大,CO转化率越大,根据图象不能确定氢气转化率变化,故D错误;
故选B.
B.X点,n(H2)/n(CO)=1.5,起始时均投入2mol CO,则投入氢气的3mol,CO的转化率为50%,则平衡时c(CO)=
| 2mol×(1-0.5) |
| 2L |
| 3mol-2mol×0.5×2 |
| 2L |
| 2mol×0.5 |
| 2L |
| c(CH3OH) |
| c(CO).c2(H2) |
| 0.5 |
| 0.5×0.5×0.5 |
C.平衡常数只与温度有关,温度不变,平衡常数不变,与物质浓度无关,故C错误;
D.根据图象中纵横坐标变化趋势知,相同条件下
| n(H2) |
| n(CO) |
故选B.
点评:本题考查了化学平衡的有关计算,明确图中综合坐标的关系是解本题关键,再结合化学平衡常数公式、平衡常数的影响因素分析解答,注意:物质浓度不影响平衡常数,只有温度影响平衡常数,为易错点.

练习册系列答案
相关题目
已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A、向醋酸溶液加水稀释时,醋酸的电离平衡逆向移动 |
| B、等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| C、a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b |
| D、同浓度CH3COONa和KCN溶液中c(Na+)-c(CH3COO-)小于的c(K+)-c(CN-) |
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量Na2CO3溶液,⑤加过量BaCl2溶液等五项操作.不正确的操作顺序是( )
| A、⑤④②①③ |
| B、④①②⑤③ |
| C、②⑤④①③ |
| D、⑤②④①③ |
下列叙述正确的是( )
| A、非金属原子间以共价键结合的物质都是共价化合物 |
| B、制催化剂的材料和制耐高温、耐腐蚀的合金材料可在过渡元素中寻找 |
| C、1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 |
| D、铷的熔点比钠高,其硫酸盐易溶于水 |
下列变化中不可能通过实验直接一步完成的是( )
| A、Al→Al[(OH)4]- |
| B、Cu→CuSO4 |
| C、Fe(OH)2→Fe(OH)3 |
| D、NH3→HNO3 |
对Na2CO3和NaHCO3这两种盐,下列叙述错误的是( )
| A、可采用加热的方法除去Na2CO3固体中混有的NaHCO3 |
| B、可向NaHCO3溶液中通入足量CO2气体除去其中混有的Na2CO3 |
| C、可用氯化钙溶液鉴别Na2CO3和NaHCO3两种溶液 |
| D、物质的量相同的Na2CO3和NaHCO3分别与足量盐酸反应,产生的CO2前者多 |
agCO2中含有b个分子,则阿伏加德罗常数为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
某无色溶液能与铝粉作用生成氢气,则溶液中可能大量共存的离子组是( )
| A、CH3COO-、K+、Na+、H+ |
| B、H+、Mg2+、Cl-、Cu2+ |
| C、OH-、Cl-、HCO3-、Mg2+ |
| D、Cl-、Ba2+、NO3-、OH- |
下列有关元素的性质及其递变规律不正确的是( )
| A、短周期主族元素的最高正价等于其所在族序数,而O、F不符合该规律 |
| B、IA族与VIIA族的元素间形成共价化合物或离子化合物时,最外层都满足8e-结构 |
| C、VIIA族元素的简单阴离子还原性越强,对应氢化物的酸性越强,非金属性越弱 |