题目内容
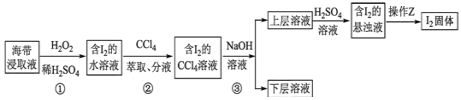
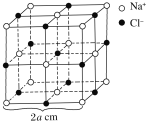
【题目】如图为NaCl晶体的一个晶胞,测知氯化钠晶体中相邻的Na+与Cl-的距离为a cm,该晶体密度为d g·cm-3,则阿伏加德罗常数可表示为多少________________________(书写计算的步骤)。
【答案】一个NaCl晶胞中含Na+:8×![]() +6×
+6×![]() =4(个);含Cl-:12×
=4(个);含Cl-:12×![]() +1=4(个),一个NaCl晶胞的体积为V=8a3cm3,由NA·d·V=4×58.5 g·mol-1得NA=
+1=4(个),一个NaCl晶胞的体积为V=8a3cm3,由NA·d·V=4×58.5 g·mol-1得NA=![]() =
=![]() mol-1
mol-1
【解析】
由氯化钠晶体中相邻的Na+与Cl-的距离为a cm,可求出1个晶胞的体积,再利用该晶体密度为d g·cm-3,可求出一个晶胞的质量。利用相对分子质量,可求出1mol晶胞的质量,由此便可求出1mol晶胞中所含晶胞的个数,从而求出阿伏加德罗常数。
一个NaCl晶胞中所含的微粒数为:含Na+:8×![]() +6×
+6×![]() =4(个);含Cl-:12×
=4(个);含Cl-:12×![]() +1=4(个),从而得出1个晶胞由4个“NaCl”构成;一个NaCl晶胞由8个小立方体构成,其体积为V=8a3cm3,1mol晶胞的质量为4×58.5 g·mol-1,从而得出NA·d·V=4×58.5 g·mol-1,故NA=
+1=4(个),从而得出1个晶胞由4个“NaCl”构成;一个NaCl晶胞由8个小立方体构成,其体积为V=8a3cm3,1mol晶胞的质量为4×58.5 g·mol-1,从而得出NA·d·V=4×58.5 g·mol-1,故NA=![]() =
=![]() mol-1。答案为:一个NaCl晶胞中含Na+:8×
mol-1。答案为:一个NaCl晶胞中含Na+:8×![]() +6×
+6×![]() =4(个);含Cl-:12×
=4(个);含Cl-:12×![]() +1=4(个),一个NaCl晶胞的体积为V=8a3cm3,由NA·d·V=4×58.5 g·mol-1得NA=
+1=4(个),一个NaCl晶胞的体积为V=8a3cm3,由NA·d·V=4×58.5 g·mol-1得NA=![]() =
=![]() mol-1。
mol-1。

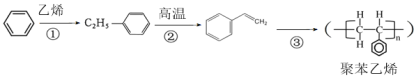
【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:

(1)X难溶于水、易溶于有机溶剂,其晶体类型为________。
(2)M所含元素的电负性由大到小顺序为_______,N原子以_____轨道与O原子形成σ键。
(3)上述反应中断裂和生成的化学键有______(填序号)。
a.离子键
b.配位键
c.金属键
d.范德华力
e.共价键
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_____。

(5)基态Cu2+的外围电子排布式为________,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是___________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
【题目】下表是前20号元素中的部分元素的一些数据:
A | B | C | D | E | F | G | H | I | J | |
原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
试回答下列问题:
(1)以上10种元素电负性最大的是_____(填元素符号)。比元素B原子序数大7的元素在元素周期表中的位置:第_____周期,第_____族,其基态原子的核外电子排布式是________。
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)__________。
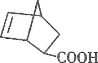
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中共形成________个σ键,________个π键。
(4)I与氢元素形成的10电子分子X的空间构型为________;将X溶于水后的溶液滴入到CuSO4溶液中至过量,得到的络离子的化学式为________,其中X与Cu2+之间以_____________键结合。
(5)下图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:
a._________________________________。
b._________________________________。
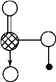
(6) 如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为_________,若晶胞边长为a cm,则晶体的密度为_______________(用含a、NA的代数式表示)(g/mL)。