题目内容
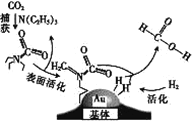
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值) ( )
A.标准状况下,22.4 L CO2中所含的电子数目为16NA
B.10.1g N(C2H5)3中所含的非极性共价键数目为1.8NA
C.2 mol Au与2 mol H2中所含的分子数目均为2NA
D.100g 46%的甲酸水溶液中所含的氧原子数目为5NA
【答案】D
【解析】
A. 标准状况下,22.4 L CO2的物质的量为1mol,1个CO2分子中含有22个电子,则1mol CO2所含的电子数目为22NA,A项错误;
B. 10.1g N(C2H5)3的物质的量为![]() ,1个N(C2H5)3分子中含有3个C-C非极性键,则0.1molN(C2H5)3含的非极性共价键数目为0.3NA,B项错误;
,1个N(C2H5)3分子中含有3个C-C非极性键,则0.1molN(C2H5)3含的非极性共价键数目为0.3NA,B项错误;
C. Au为金属单质,由金属阳离子和自由电子构成,不含有分子,C项错误;
D. 100g46%的甲酸溶液中甲酸的质量为46g,物质的量为1mol,故含2NA个氧原子;而水的物质的量为54g,物质的量为3mol,故含3NA个氧原子,故溶液中共含5NA个氧原子,D项正确;
答案选D。

练习册系列答案
相关题目