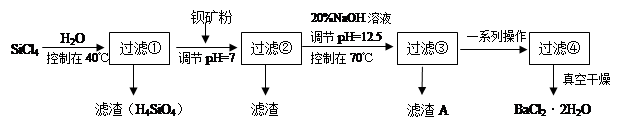��Ŀ����
һ�������£�ͨ�����з�Ӧ��ʵ��ȼú��������Ļ��գ�
2CO(g)+SO2(g)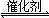 2CO2(g)+S(l) ��H
2CO2(g)+S(l) ��H
��1����֪2CO(g)+O2(g)= 2CO2(g) ��H1=��566kJ?mol��1
S(l) +O2(g)= SO2(g) ��H2=��296kJ?mol��1
��Ӧ�Ȧ�H= kJ?mol��1��
��2������������ͬ��������ͬʱ��SO2��ת�����淴Ӧ�¶ȵı仯��ͼa��260��ʱ ����Fe2O3��NiO��Cr2O3����������Ӧ������졣Fe2O3��NiO����������ʹSO2��ת���ʴﵽ��ߣ������Ǽ۸����أ�ѡ��Fe2O3����Ҫ�ŵ��� ��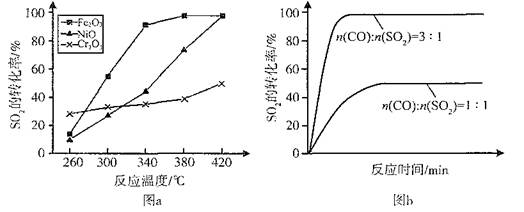
��3������С����380�桢Fe2O3������ʱ���о��˲�ͬͶ�ϱ�[n(CO)��n(SO2)]��SO2ת���ʵ�Ӱ�죬�����ͼb�����ڴ������ͼ�л���n(CO)��n(SO2)="2��1" ʱ��SO2ת���ʵ�Ԥ�ڱ仯���ߡ�
��4����ҵ�ϻ�����Na2SO3��Һ���������е�SO2��Na2SO3+SO2+H2O=2NaHSO3��ij�¶�����1.0mol?L��1 Na2SO3��Һ���մ�����SO2������Һ��c(SO32��)����0.2mol?L��1ʱ���������������½���Ӧ�������ռ���
�ٴ�ʱ��Һ��c(HSO3��)ԼΪ______mol?L��1��
�ڴ�ʱ��ҺpH=______������֪���¶���SO32��+H+ HSO3����ƽ�ⳣ��K="8.0" �� 106 L?mol��1������ʱSO2��H2SO3��Ũ�Ⱥ��Բ��ƣ�
HSO3����ƽ�ⳣ��K="8.0" �� 106 L?mol��1������ʱSO2��H2SO3��Ũ�Ⱥ��Բ��ƣ�
��16�֣�
��1����270 ��3�֣�
��2��Cr2O3 ��3�֣� Fe2O3������ʱ������Խϵ��¶ȿɻ�ýϸ�SO2��ת���ʣ��Ӷ���Լ������Դ��3�֣�
��3������ͼ ��3�֣�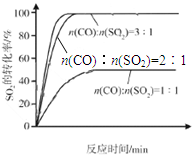
��4����1.6 ��2�֣� ��6 ��2�֣�
���������������1���۲��Ȼ�ѧ����ʽ֮��Ĺ�ϵ��������֪��1���Ȼ�ѧ����ʽ��ȥ��2���Ȼ�ѧ����ʽʱ���ܹ�ԼȥO2(g)�õ�2CO(g)+SO2(g) 2CO2(g)+S(l)�����ݸ�˹���ɣ��÷�Ӧ�Ȧ�H=��H1����H2=��270kJ?mol��1����2����ͼa��֪��260��ʱƽ��ת���ʣ�Cr2O3> Fe2O3>NiO���ɴ��ƶ�Cr2O3������ʱ��Ӧ������죻��ͼ��֪��Fe2O3��NiO����������ʹSO2��ת���ʴﵽ��ߣ���SO2��ת������ͬʱ����Ӧ�¶ȣ�Fe2O3<NiO������Fe2O3������ʱ����Ҫ�ŵ�������Խϵ��¶ȿɻ�ýϸ�SO2��ת���ʣ��Ӷ���Լ������Դ����3����ͼb��֪������������ͬʱ������n(CO)��n(SO2)�ı�ֵ����������CO��Ӧ��Ũ�ȣ���������Ӧ���ʣ����̴ﵽƽ���ʱ�䣬��ʹƽ��������Ӧ��Ӧ�����ƶ���ʹSO2��ת������������ͼa��380��ʱSO2��ת������ߣ�����n(CO)��n(SO2)�ı�ֵΪ2��1��Ϊ3��1ʱ��SO2��ƽ��ת���ʻ�������ȫ��ͬ��ֻ�Ǵﵽƽ���ʱ�����̣��ɴ˿�����ͼb�л����й��¶ȶԷ�Ӧ���ʺ�ƽ���ƶ���Ӱ��ͼ��4�������⣬Na2SO3��NaHSO3����ǿ����ʣ������ƶϷ�Ӧ������������ʼŨ�ȡ��仯Ũ�ȡ������Լ�ʱŨ�ȣ���
2CO2(g)+S(l)�����ݸ�˹���ɣ��÷�Ӧ�Ȧ�H=��H1����H2=��270kJ?mol��1����2����ͼa��֪��260��ʱƽ��ת���ʣ�Cr2O3> Fe2O3>NiO���ɴ��ƶ�Cr2O3������ʱ��Ӧ������죻��ͼ��֪��Fe2O3��NiO����������ʹSO2��ת���ʴﵽ��ߣ���SO2��ת������ͬʱ����Ӧ�¶ȣ�Fe2O3<NiO������Fe2O3������ʱ����Ҫ�ŵ�������Խϵ��¶ȿɻ�ýϸ�SO2��ת���ʣ��Ӷ���Լ������Դ����3����ͼb��֪������������ͬʱ������n(CO)��n(SO2)�ı�ֵ����������CO��Ӧ��Ũ�ȣ���������Ӧ���ʣ����̴ﵽƽ���ʱ�䣬��ʹƽ��������Ӧ��Ӧ�����ƶ���ʹSO2��ת������������ͼa��380��ʱSO2��ת������ߣ�����n(CO)��n(SO2)�ı�ֵΪ2��1��Ϊ3��1ʱ��SO2��ƽ��ת���ʻ�������ȫ��ͬ��ֻ�Ǵﵽƽ���ʱ�����̣��ɴ˿�����ͼb�л����й��¶ȶԷ�Ӧ���ʺ�ƽ���ƶ���Ӱ��ͼ��4�������⣬Na2SO3��NaHSO3����ǿ����ʣ������ƶϷ�Ӧ������������ʼŨ�ȡ��仯Ũ�ȡ������Լ�ʱŨ�ȣ���
SO32��+SO2+H2O=2HSO3��
��ʼŨ�ȣ�mol/L�� 1.0 0
�仯Ũ�ȣ�mol/L�� 0.8 1.6
�����Լ�ʱŨ�ȣ�mol/L�� 0.2 1.6
������Լ�ʱ��c(HSO3��)=1.6mol/L
����SO32��+H+ HSO3����ƽ�ⳣ��K= c(HSO3��)/[ c(SO32��)? c(H+)]����c(H+)= c(HSO3��)/[ c(SO32��)?K)]������c(HSO3��)=1.6mol/L��c(SO32��)=0.2mol/L�����¶���K="8.0" �� 106 L?mol��1����c(H+)=1.6/(0.2��8.0 �� 106) mol/L=10��6 mol/L��������Һ��pH="��lg" c(H+)=������6��=6��
HSO3����ƽ�ⳣ��K= c(HSO3��)/[ c(SO32��)? c(H+)]����c(H+)= c(HSO3��)/[ c(SO32��)?K)]������c(HSO3��)=1.6mol/L��c(SO32��)=0.2mol/L�����¶���K="8.0" �� 106 L?mol��1����c(H+)=1.6/(0.2��8.0 �� 106) mol/L=10��6 mol/L��������Һ��pH="��lg" c(H+)=������6��=6��
���㣺���黯ѧ��Ӧԭ�����漰��˹���ɡ����ͼ������������¶ȶԷ�Ӧ���ʼ���Ӧ��ת���ʵ�Ӱ����ɡ�����ѡ��������ŵ㡢�����ض��¶��·�Ӧ����ȶԷ�Ӧ���ʺ�ƽ���ƶ���Ӱ��ͼ�����ʵ�������Ũ�ȣ������ӷ���ʽ�����е�Ӧ�á����ݷ�Ӧ��仯Ũ�ȼ���������ı仯Ũ�ȡ��������ݷ����йؼ��㡢����ƽ�ⳣ�����йؼ��㡢��ҺpH�ļ���ȡ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д��ϳɰ���ҵ�Թ���������Ҫ���壬�������ᡢ�ϳ���ά�Լ�Ⱦ�ϵ�
��1����֪ijЩ��ѧ���ļ����������±���
| ��ѧ�� | N��N | H��H | N��H |
| ����kJ��mol��1 | 946 | 436 | 390 |
�ϳɰ����Ȼ�ѧ��Ӧ����ʽΪ ��
��2�������£���NaCl�뱥�Ͱ�ˮ�Ļ����Һ��ͨ�����CO2����NaHCO3�����������÷�Ӧ�Ļ�ѧ����ʽΪ ��������Һ�����ӵĵ���غ�ʽ�� ������NaCl�뱥��CO2�Ļ����Һ��ͨ�백������û��NaHCO3����������ԭ���� ��
��3��������ˮ(��NH3��NaOH��Na2SO4)�����ŷŻ����ˮ�帻Ӫ��������ͼͨ��ֱ�ӵ绯ѧ��������Ч��ȥij�������������������ӵ���������Ϊ �����a��������b���������������У�b������pH �������С�����䡱����������Ӧ����ʽΪ ��
I����¯������ұ��������Ҫ��������������Ҫ��ӦΪ��
Fe2O3(s) + 3CO(g) 2Fe(s)+3CO2(g) ��H
2Fe(s)+3CO2(g) ��H
��1����֪����Fe2O3(s) + 3C(ʯī)="2Fe(s)" + 3CO(g) ��H1
��C(ʯī��+ CO2(g) = 2CO(g) ��H2
���H___________________(�ú���H1 ����H2�Ĵ���ʽ��ʾ)��
��2����¯������Ӧ��ƽ�ⳣ������ʽK=____________________________��
��3����ij�¶�ʱ���÷�Ӧ��ƽ�ⳣ��K=64����2L�����ܱ����������У��ֱ��±���ʾ�������ʣ���Ӧ����һ��ʱ���ﵽƽ�⡣
| | Fe2O3 | CO | Fe | CO2 |
| ��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| ��/mol | 1.0 | 1.5 | 1.0 | 1.0 |
�ټ�������CO��ƽ��ת����Ϊ_______________________��
������˵����ȷ����____________________(���ţ���
A��������ѹǿ�㶨����Ӧ�ﵽƽ��״̬
B���������������ܶȺ㶨����Ӧ�ﵽƽ��״̬
C����������CO��ƽ��ת���ʴ����ҵ�
D������Fe2O3�������CO��ת����
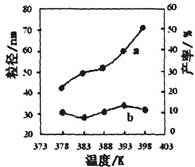
II������MgO�����������Ȼ�þ�ϳɡ�ijС���о��÷�Ӧ���¶�Ϊ378��398Kʱ�ķ�Ӧʱ�䡢��Ӧ����ȵ����ض�����ʵ�Ӱ�졣���������ʵ����Ʊ���
| ��� | �¶�/K | ��Ӧʱ��/h | ��Ӧ�����ʵ������ | ʵ��Ŀ�� |
| �� | 378 | 4 | 3��1 | ʵ��ں͢�̽��________ ______________________ ʵ��ں�__________̽�� ��Ӧʱ��Բ��ʵ�Ӱ�졣 |
| �� | 378 | 4 | 4��1 | |
| �� | 378 | 3 | _______ | |
| �� | 398 | 4 | 4��1 |
��ͼΪ�¶ȶ�����MgO���ʣ�����a��������(����b)��Ӱ�죬����ɳ��¶ȶ�����MgO�Ʊ���Ӱ����ɣ�д��һ������
___________________________________________��
�Ҵ������DZ��㷺ʹ�õ��������ȼ�ϣ���ҵ�����Ҵ���һ�ַ�Ӧԭ��Ϊ��
2CO(g) + 4H2(g) CH3CH2OH(g) + H2O(g) ��H =" ��256.1" kJ��mol��1
CH3CH2OH(g) + H2O(g) ��H =" ��256.1" kJ��mol��1
��֪��CO(g) + H2O(g) CO2(g)+H2(g) ��H=" ��41.2" kJ��mol��1
CO2(g)+H2(g) ��H=" ��41.2" kJ��mol��1
��1����CO2(g)��H2(g)Ϊԭ��Ҳ�ɺϳ��Ҵ������Ȼ�ѧ����ʽ���£�
2CO2(g) +6H2(g) CH3CH2OH(g) +3H2O(g) ��H = ��
CH3CH2OH(g) +3H2O(g) ��H = ��
��2������ʹ���Ҵ����Ͳ����ܼ���NOx���ŷţ���ʹNOx����Ч������Ϊ�����������Ҫ���⡣
��ij�о�С����ʵ������Ag�C ZSM�C 5Ϊ���������NOת��ΪN2��ת�������¶ȱ仯�������ͼ������ʹ��CO���¶ȳ���800�棬����NO��ת���ʽ��ͣ�����ܵ�ԭ��Ϊ ����n(NO)/n(C O)=1�������£�Ӧ���Ƶ�����¶��� ���ҡ�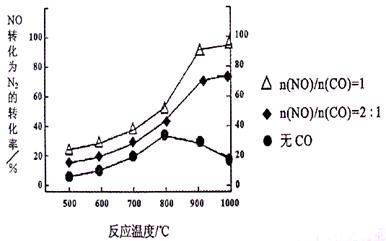
���û���̿��ԭ��������������йط�ӦΪ��C (s) +2NO2(g) N2 (g) + CO2 (g)��ij�о�С����ij�ܱ������м��������Ļ���̿��NO������( T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2 (g) + CO2 (g)��ij�о�С����ij�ܱ������м��������Ļ���̿��NO������( T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
| �� Ũ��/mol?L��1 ʱ��/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
I�����ݱ������ݣ���Ӧ��ʼ��20min��v(NO)��ʾ�ķ�Ӧ����Ϊ (������λ��Ч����)��T1��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ (������λ��Ч����)��
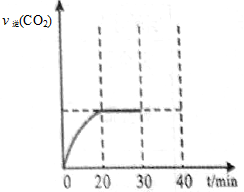
II��30min�ı�ijһ��������Ӧ���´ﵽƽ�⣬��ı������������ ����ͼ��ʾCO2���淴Ӧ����[v��(CO2)]�淴Ӧʱ��ı仯��ϵͼ������ͼ�л�����30min�ı���������ʱ����40minʱ���ٴδﵽƽ��ı仯���ߡ�
����β���е��ж�����NO��CO����һ�������¿ɷ�����Ӧ����N2��CO2�����й��ڴ˷�Ӧ��˵���У���ȷ����
| A����Сѹǿ������Ӧ���� | B������ѹǿ�ܼ�С��Ӧ���� |
| C��ʹ���ʵ��Ĵ���������Ӧ���� | D�������¶ȶԷ�Ӧ������Ӱ�� |
����¡����ݣ�2L�����ܱ������г���2molX��һ������Y��������Ӧ��2X(g)��Y(g)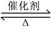 2Z(g)
2Z(g)
��H��0��4min��ﵽƽ��c(X)��0.2mol��L-1����X��Y��ת������ȡ�����˵���в���ȷ���ǣ� ��
| A���ﵽƽ��ʱ���ٳ���1molX����Ӧ���ʱ䱣�ֲ��� |
| B����Y��ʾ4min�ڵķ�Ӧ����Ϊ0.1 mol��L-1��min-1 |
| C�����������г���1molZ���ﵽ��ƽ�⣬c(X)��c(Y)��2��1 |
| D��4min���������¶ȣ�ƽ�ⳣ��K���� |