题目内容
合成氨工业对国防具有重要意义,如制硝酸、合成纤维以及染料等
(1)已知某些化学键的键能数据如下表:
| 化学键 | N≡N | H—H | N—H |
| 键能kJ·mol-1 | 946 | 436 | 390 |
合成氨的热化学反应方程式为 。
(2)常温下,向饱和NaCl与饱和氨水的混合溶液中通入过量CO2,有NaHCO3固体析出,该反应的化学方程式为 ;所得溶液中离子的电荷守恒式是 ;若向饱和NaCl与饱和CO2的混合溶液中通入氨气,则没有NaHCO3固体析出,原因是 。
(3)氨氮废水(含NH3、NaOH和Na2SO4)超标排放会造成水体富营养化。右图通过直接电化学氧化法有效除去某工厂氨气。其中阴离子的流动方向为 (填“向a极”或“向b极”),电解过程中,b极区的pH (填“增大”或“减小”或“不变”),阳极反应方程式为 。
(1)N2(g)+3H2(g) 2NH3(g) ΔH=-86kJ/mol
2NH3(g) ΔH=-86kJ/mol
(2)NaCl+CO2+NH3·H2O=NH4Cl+NaHCO3↓
c(Na+)+c(H+)+c(NH4+)=c(Cl-)+c(HCO3-)+2c(CO32-)+c(OH-)
二氧化碳的溶解度小,生成的碳酸氢铵太少,故没有碳酸氢钠析出
(3)向a极 增大 2NH3-6e-+6OH-=N2+6H2O
解析试题分析:(1)旧键断裂吸热:946+3×436=2254kJ;新建合成放热:6×390=2340kJ;放热多,化学反应表现
为放热,放出热量86kJ,不难写出相关热化学方程式,同时注意:?标明物质的聚集状态;?标明单位:
kJ·mol-1。(2)根据反应物和产物,利用守恒定律,不难写出相关方程式;根据溶液呈电中性,正电荷总
数等于负电荷总数,写出电荷守恒;二氧化碳在水中的溶解度很小,生成的碳酸氢根离子浓度很小,
故没有碳酸氢钠析出。(3)阴离子移向阳极;阳极氢离子放电,剩余氢氧根离子,溶液pH增大。
考点:考查反应热的计算,电解化学方程式书写。

氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH =" -483.6" kJ/mol
3H2 (g) + N2 (g)  2NH3 (g) ΔH =" -92.4" kJ/mol
2NH3 (g) ΔH =" -92.4" kJ/mol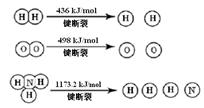
计算断裂1 mol N≡N键需要能量 kJ , 氮气分子中化学键比氧气分子中的化学键键 (填“强”或“弱”),因此氢气与二者反应的条件不同。
(2)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:N2 (g) + O2 (g) =" 2NO" (g) ΔH =" +180.8" kJ/mol ,工业合成氨则是人工固氮。
分析两种固氮反应的平衡常数,下列结论正确的是 。
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料, 发生反应:3H2 (g) + N2 (g)
 2NH3 (g)测得甲容器中H2的转化率为40%。
2NH3 (g)测得甲容器中H2的转化率为40%。| | N2 | H2 | NH3 |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为 。
(4)氨气是合成硝酸的原料,写出氨气与氧气反应生成一氧化氮和气态水的热化学方程式 。
工业上在催化剂作用下可利用CO合成甲醇:CO(g)+2H2(g) CH3OH(g),图1表示反应过程中能量的变化情况。
CH3OH(g),图1表示反应过程中能量的变化情况。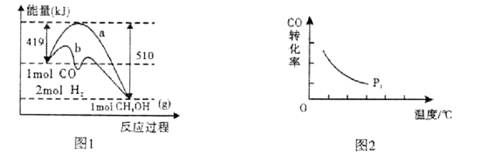
请回答下列问题:
(1)在图I中,曲线______(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)为探究外界条件对合成甲醇化学反应速率的影响规律,某科技工作者设计了以下三组实验,部分数据已填人表中,请补充完整。
| 实验组 | T/℃ | 起始浓度/mol?L-1 | 等质量催化剂的 比表面积/m2?g-1 | |
| CO | H2 | |||
| ① | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| ② | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| ③ | 350 | | | 124 |
其中设计实验组①和②的目的是______。
(3)“图2”所揭示的规律是:在p1压强达平衡时______;并请画出在p2压强下(p2> p1)的曲线。
(4)在碱性条件下可将合成甲醇的反应设计成原电池,则负极的电极反应式为______。
研究硫及其化合物的性质有重要意义。
(1)Cu2S在高温条件下发生如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ⊿H=-773kJ/mol
当该反应有1.2mol电子转移时,反应释放出的热量为 kJ。
(2)硫酸工业生产中涉及反应:2SO2(g)+O2(g)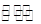 2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。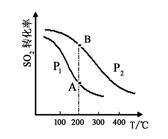
①压强:P1 P2(填“>”、“=”或“<”)。
②平衡常数:A点 B点(填“>”、“=”或“<”)。
③200℃下,将一定量的SO2和O2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 | SO2 | O2 | SO3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
能说明该反应达到化学平衡状态的是 。
a.SO2和O2的体积比保持不变
b.体系的压强保持不变
c.混合气体的密度保持不变
d.SO2和SO3物质的量之和保持不变
计算上述反应在0~10min内,υ(O2)= 。
(3)一定温度下,用水吸收SO2气体时,溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若得到pH=3的H2SO3溶液,试计算溶液中
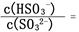 。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L)
。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L) 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1) 用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) ="4NO(g)" + CO2(g) +2H2O(g) ⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g) ⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l) △H=" -44.0" kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
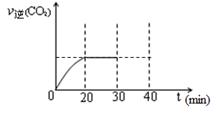
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
 浓度/mol·L-1 浓度/mol·L-1
| NO | N2 | CO2 | ||
| 0 | 1.00 | 0 | 0 | ||
| 10 | 0.58 | 0.21 | 0.21 | ||
| 20 | 0.40 | 0.30 | 0.30 | ||
| 30 | 0.40 | 0.30 | 0.30 | ||
| 40 | 0.32 | 0.34 | 0.17 | ||
| 50 | 0.32 | 0.34 | 0.17 |
②根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”) 。
④下列各项能作为判断该反应达到平衡的是 (填序号字母)。
A.容器内压强保持不变 B. 2v正(NO) = v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是 。请在下图中画出30min至40min的变化曲线。
 键分别需要的能量是436kJ、391KJ、946kJ,则N2与H2反应生成1mol NH3(g)的热化学方程式是___________________.
键分别需要的能量是436kJ、391KJ、946kJ,则N2与H2反应生成1mol NH3(g)的热化学方程式是___________________. CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0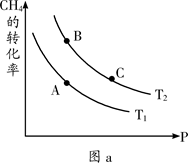
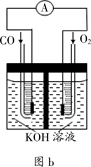
 2CO2(g)+S(l) △H
2CO2(g)+S(l) △H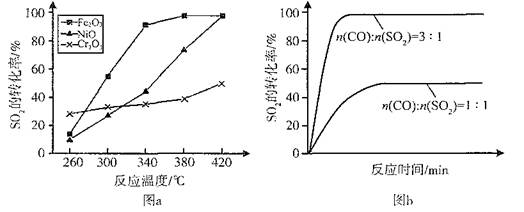
 HSO3—的平衡常数K="8.0" × 106 L?mol-1,计算时SO2、H2SO3的浓度忽略不计)
HSO3—的平衡常数K="8.0" × 106 L?mol-1,计算时SO2、H2SO3的浓度忽略不计)