题目内容
在某密闭容器中有16L NO和 NH3的混合气体,在催化剂和加热条件下发生 如下反应: 6NO + 4NH3  6 H2O + 5N2,当各物质的浓度不随时间变化时,混合气体的体积为17L,则原混合气体中NO和 NH3的体积之比为
6 H2O + 5N2,当各物质的浓度不随时间变化时,混合气体的体积为17L,则原混合气体中NO和 NH3的体积之比为
①3:5 ②3:4 ③3:2 ④3:1
 6 H2O + 5N2,当各物质的浓度不随时间变化时,混合气体的体积为17L,则原混合气体中NO和 NH3的体积之比为
6 H2O + 5N2,当各物质的浓度不随时间变化时,混合气体的体积为17L,则原混合气体中NO和 NH3的体积之比为①3:5 ②3:4 ③3:2 ④3:1
| A.①④ | B.②③ | C.①② | D.③④ |
B
由方程式6NO + 4NH3  6 H2O + 5N2,设起始体积NO为xL,NH3为yL;
6 H2O + 5N2,设起始体积NO为xL,NH3为yL;
起始物质的体积: x y 0 0
变化物质的体积: 6a 4a 6a 5a
平衡物质的体积:x-6a y-4a 6a 5a
则,x-6a+ y-4a+6a+5a=x+y+a=17;由于x+y=16,所以a=1;假设反应为非可逆反应,若(1)NO过量,即原混合气体中NH3的体积为4L,NO的体积为12L,混合气体中NO和 NH3的体积之比为3:1;若(2)NH3过量,即原混合气体中NH3的体积为10L,NO的体积为6L,混合气体中NO和 NH3的体积之比为3:5;因为该反应为可逆反应,反应物不可能完全转化,即可得原混合气体中NO和 NH3的体积之比介于3:5和3:1之间;正确选项为B;
 6 H2O + 5N2,设起始体积NO为xL,NH3为yL;
6 H2O + 5N2,设起始体积NO为xL,NH3为yL;起始物质的体积: x y 0 0
变化物质的体积: 6a 4a 6a 5a
平衡物质的体积:x-6a y-4a 6a 5a
则,x-6a+ y-4a+6a+5a=x+y+a=17;由于x+y=16,所以a=1;假设反应为非可逆反应,若(1)NO过量,即原混合气体中NH3的体积为4L,NO的体积为12L,混合气体中NO和 NH3的体积之比为3:1;若(2)NH3过量,即原混合气体中NH3的体积为10L,NO的体积为6L,混合气体中NO和 NH3的体积之比为3:5;因为该反应为可逆反应,反应物不可能完全转化,即可得原混合气体中NO和 NH3的体积之比介于3:5和3:1之间;正确选项为B;

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。 SO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol , 则达到平衡时SO2的转化率为 。(1分)
SO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol , 则达到平衡时SO2的转化率为 。(1分)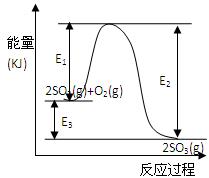
 SO3
SO3 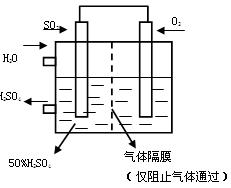
 O2和水的质量比为 (2分)
O2和水的质量比为 (2分) 2C(g),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,下列几种说法中不正确的是:
2C(g),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,下列几种说法中不正确的是: 和8mol
和8mol 在一定条件下反应,达到平衡时,
在一定条件下反应,达到平衡时,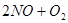

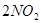 达到平衡的标志是
达到平衡的标志是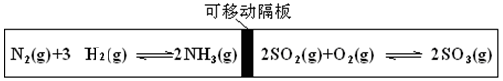
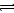 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时各物质的浓度可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时各物质的浓度可能是( ) xC(g)2min时反应平衡,剩余0.8molB,并测得C的浓度为0.4mol/L.
xC(g)2min时反应平衡,剩余0.8molB,并测得C的浓度为0.4mol/L.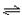 xC(g)+2D(g),经5 min后达平衡状态,此时测得D的浓度为0.5 mol/L,混合气体的总体积为134.4 L(标准状况),C的平均反应速率为0.1 mol/(L·min).试求:
xC(g)+2D(g),经5 min后达平衡状态,此时测得D的浓度为0.5 mol/L,混合气体的总体积为134.4 L(标准状况),C的平均反应速率为0.1 mol/(L·min).试求: